kategorier: Utvalda artiklar » Nybörjare elektriker
Antal visningar: 36288
Kommentarer till artikeln: 1
Kemiska strömkällor: huvudsakliga egenskaper
 I mer än två århundraden har mänskligheten använt energin från kemiska reaktioner mellan olika ämnen för att producera likström.
I mer än två århundraden har mänskligheten använt energin från kemiska reaktioner mellan olika ämnen för att producera likström.
Arbetsprincip
Redoxreaktionen som inträffar mellan ämnen med egenskaperna hos ett oxidationsmedel och ett reducerande medel åtföljs av frisättningen av elektroner, vars rörelse bildar en elektrisk ström. För att använda sin energi är det emellertid nödvändigt att skapa förhållanden för passage av elektroner genom en extern krets, annars frigörs den av värme från en enkel blandning av ett oxidationsmedel och ett reduktionsmedel.
Därför har alla kemiska strömkällor två elektroder:
-
den anod på vilken oxidation sker;
-
katod som utför reduktionen av ett ämne
Elektroder på avstånd placeras i ett kärl med en elektrolyt - ett ämne som leder elektrisk ström på grund av processerna för dissociation av mediet till joner.
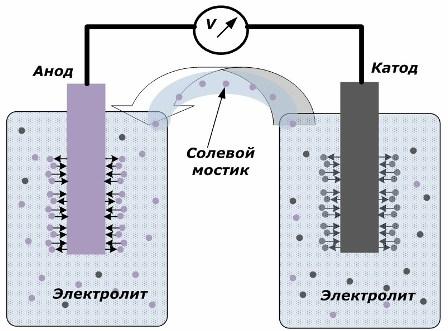
Principen för att konvertera kemisk energi till elektrisk energi
Figuren visar att elektroderna är placerade i separata kärl förbundna med en saltbro genom vilken jons rörelse längs den inre kretsen skapas. När de externa och inre kretsarna är öppna, inträffar två processer på elektroderna: övergången av joner från metallen från elektroden till elektrolyten och övergången av joner från elektrolyten till kristallgitteret på elektroderna.
Hastigheterna för dessa processer är desamma och spänningspotentialen för motsatta tecken ackumuleras på varje elektrod. Om de är anslutna genom en saltbro och en last appliceras kommer en elektrisk krets att inträffa. En intern ström alstras genom rörelsen av joner mellan elektroderna genom elektrolyten och saltbryggan. Rörelser av elektroner längs den externa kretsen i riktningen från anoden till katoden.
Nästan alla redoxreaktioner åtföljs av elproduktion. Men dess värde beror på många faktorer, inklusive volymer och massor av de kemikalier som används, materialen som används för att tillverka elektroderna, såsom elektrolyt, jonkoncentration, design.
De mest använda i moderna kemiska strömkällor är:
-
för materialet i anoden (reduktionsmedel), zink (Zn), bly (Pb), kadmium (Cd) och vissa andra metaller;
-
för katodmaterialet (oxidationsmedel) - blyoxid PbO2, manganoxid MnO2, nickelhydroxid NiOOH och andra;
-
elektrolyter baserade på lösningar av syror, alkalier eller salter.
Klassificeringsmetoder
Den ena delen av kemiska kraftkällor kan återanvändas, medan den andra inte kan. Denna princip tas som grund för deras klassificering.
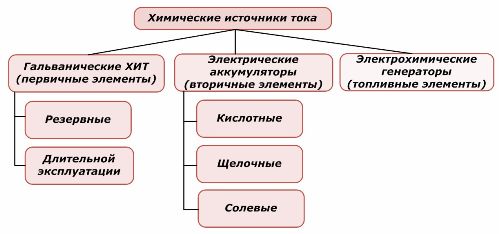
Klassificering av kemiska element
Elektromotorisk kraft galvaniska celler, beroende på design, når 1,2 ÷ 1,5 volt. För att få stora värden kombineras de till batterier och ansluter i serie. När batterierna är anslutna parallellt ökar strömmen och effekten.
Det är allmänt accepterat att primära kemiska strömkällor inte stöder laddning, men mer exakt kan denna position formuleras annorlunda: dess genomförande är inte ekonomiskt genomförbart.
Redundanta primära kemiska strömkällor lagras i ett tillstånd där elektrolyten isoleras från elektroderna. Detta eliminerar förekomsten av redoxreaktionen och säkerställer beredskapen för idrifttagning. De återanvänds inte. Hållbarheten för kemiska reservkraftkällor är begränsad till 10–15 år.
Batterier laddas framgångsrikt genom applicering av extern elektrisk energi. På grund av denna funktion kallas de sekundära strömkällor. De kan motstå hundratusentals laddningsladdningscykler.Batteriets EMF kan ligga inom intervallet 1,0 ÷ 1,5 volt. De kombineras också till batterier.
Elektrokemiska generatorer arbetar med principen om galvaniska celler, men för att utföra den elektrokemiska reaktionen kommer ämnen från utsidan, och alla frisatta produkter tas bort från elektrolyten. Detta gör att du kan organisera en kontinuerlig process.
Viktiga egenskaper hos kemiska kraftkällor
1. Spänningen över öppna terminaler
Beroende på design kan en enda källa endast skapa en viss potentialskillnad. För användning i elektriska apparater kombineras de till batterier.
2. Specifik kapacitet
Under en viss tid (i timmar) kan en kemisk strömkälla generera en begränsad mängd ström (i ampère), som tillskrivs en vikt eller volymenhet.
3. Effektdensitet
Det kännetecknar förmågan hos en vikt- eller volymenhet hos en kemisk strömkälla att generera effekt genererad av produkten av spänning genom strömstyrka.
4. Drifttid
Denna parameter kallas också utgångsdatumet.
5. Värdet på självutladdningsströmmar
Dessa sidoprocesser av elektrokemiska reaktioner leder till konsumtion av den aktiva massan hos elementen, orsakar korrosion och minskar den specifika kapaciteten.
6. Produktpris
Beror på design, material som används och ett antal andra faktorer.
De bästa kemiska strömkällorna är de med höga värden för de första fyra parametrarna, och självutladdning och kostnad är låga.
Principer för batteriladdning
Bland sekundära kemiska strömkällor får de stor popularitet. litiumjonmodeller, som har blivit vanligt för att driva elektroniska apparater. De använder LiMO2 (M Co, Ni, Mn) som material i den positiva elektroden och grafit som negativ.
Vid laddning frigörs litiumjoner från den applicerade externa energin från katodmetallen, passerar genom elektrolyten och tränger in i utrymmet mellan grafitlagren och ackumuleras där.
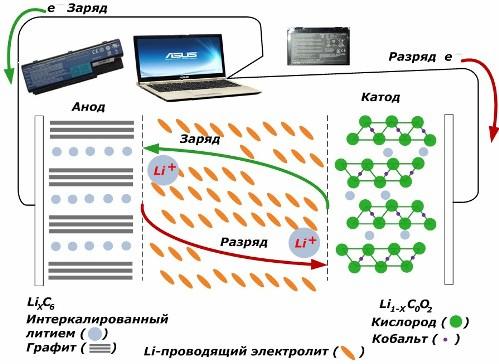
När energin laddare frånvarande, och belastningen är ansluten till elektroderna, sedan rör sig litiumjoner i elektrolyten i motsatt riktning.
Om laddningen och urladdningen inte utförs förbrukas inte energin i batteriet utan lagras. Men mängden begränsas av egenskaperna hos de använda materialen. Till exempel i litiumjonbatterier är den specifika elektriska kapaciteten 130 130 150 mAh / g. Det begränsas av anodmaterialets egenskaper. För grafit är kapaciteten ungefär två gånger högre.
Forskare letar nu efter sätt att öka batterikapaciteten, undersöker möjligheten att använda en kemisk reaktion mellan litium och syre i luften. För att göra detta utvecklas mönster med en luftkatod som inte kan användas och används i separata batterier. Denna metod kan öka energitätheten upp till 10 gånger.
Drift av kemiska strömkällor kräver kunskap grunderna i elektroteknik, elektrokemi, materialvetenskap och fysik i fast tillstånd.
Se även på elektrohomepro.com
:
