kategorier: Utvalda artiklar » Nybörjare elektriker
Antal visningar: 70526
Kommentarer till artikeln: 0
Galvaniska celler - enhet, funktionsprincip, typer och huvudegenskaper
Förutsättningar för utseendet på galvaniska celler. Lite historia. År 1786 upptäckte den italienska professor i medicin, fysiolog Luigi Aloisio Galvani ett intressant fenomen: musklerna i bakbenen i ett nyöppnat lik av en groda upphängd på kopparkrokar drabbades när forskaren berörde dem med en stålskalpel. Galvani drog omedelbart slutsatsen att detta var en manifestation av "animalisk elektricitet."
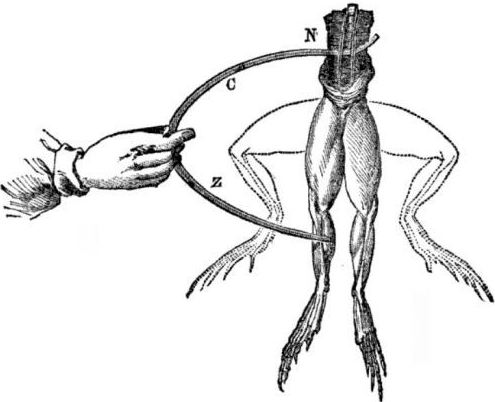
Efter Galvanis död kommer hans samtida Alessandro Volta, som kemist och fysiker, att beskriva och offentligt visa en mer realistisk mekanism för förekomst av elektrisk ström när olika metaller kommer i kontakt.
Volta kommer efter en serie experiment att komma till den entydiga slutsatsen att strömmen förekommer i kretsen på grund av närvaron i den av två ledare av olika metaller placerade i en vätska, och detta är inte alls "animalisk elektricitet", som Galvani trodde. Ritningen av grodans ben var en konsekvens av strömmens verkan som berodde på kontakt med olika metaller (kopparkrokar och en skalpell av stål).
Volta kommer att visa samma fenomen som Galvani visade på en död groda, men på en helt livlöst hemmagjord elektrometer, och 1800 kommer att ge en exakt förklaring av strömmen: ”den andra klassens ledare (vätska) är i mitten och är i kontakt med två förstklassiga ledare av två olika metaller ... Som ett resultat av detta uppstår en elektrisk ström i en eller annan riktning. ”

I ett av de första experimenten sänkte Volta två plattor - zink och koppar - i en burk med syra och kopplade dem med tråd. Därefter började zinkplattan upplösas och gasbubblor bildades på kopparstålet. Volta föreslog och bevisade att elektrisk ström flyter genom ledningen.
Således uppfanns "Volta-elementet" - den första galvaniska cellen. För enkelhets skull gav Volta den formen av en vertikal cylinder (pelare), bestående av sammankopplade ringar av zink, koppar och tyg impregnerad med syra. En halv meter hög voltpol skapade en spänning som är känslig för människor.
Sedan början av forskningen lades av Luigi Galvani, namnet kemisk strömkälla bevarade minnet om honom i hans namn.
Galvanisk cell Är en kemisk källa till elektrisk ström, baserad på samverkan mellan två metaller och / eller deras oxider i en elektrolyt, vilket leder till uppkomsten av en elektrisk ström i en sluten krets. I galvaniska celler omvandlas sålunda kemisk energi till elektrisk energi.
Celler idag

Celler idag kallas batterier. Tre typer av batterier är utbredda: saltlösning (torr), alkalisk (de kallas också alkaliskt, "alkaliskt" i översättning från engelska - "alkaliskt") och litium. Principen för deras arbete är densamma som beskrivs av Volta 1800: två metaller interagera genom elektrolytoch en elektrisk ström uppstår i en extern stängd krets.
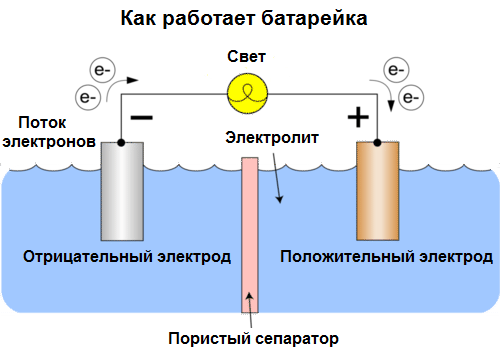
Batterispänning beror på de använda metallerna och antalet celler i "batteriet". Till skillnad från batterier kan batterier inte återställa sina egenskaper eftersom de direkt omvandlar kemisk energi, det vill säga energin från reagensen (reduktionsmedel och oxidationsmedel) som utgör batteriet till elektrisk energi.
De reagenser som ingår i batteriet konsumeras under dess drift, strömmen minskar gradvis, därför slutar källans verkan efter att reagensen helt har reagerat.
Alkaliska och saltelement (batterier) används ofta för att driva en mängd olika elektroniska apparater, radioutrustning, leksaker och litium kan oftast hittas i bärbara medicinska apparater som blodsockermätare eller i digital teknik som kameror.

Saltbatterier
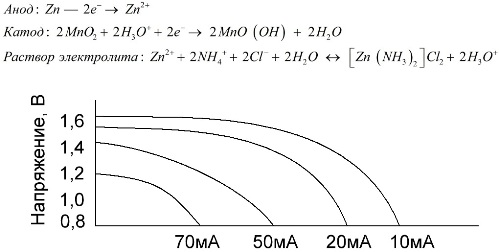
Mangan-zinkceller, som kallas saltbatterier, är ”torra” galvaniska celler, i vilka det inte finns någon flytande elektrolytlösning.
En zinkelektrod (+) är en koppformad katod och en pulverformig blandning av mangandioxid och grafit tjänar som anoden. Ström flyter genom en grafitstång. Som en elektrolyt används en pasta från en lösning av ammoniumklorid med tillsats av stärkelse eller mjöl för att tjockna, så att ingenting flyter.
Vanligtvis indikerar inte batterietillverkarna den exakta sammansättningen av saltelementen, men saltbatterier är dock de billigaste, de används vanligtvis på enheter där strömförbrukningen är extremt låg: i timmar, i fjärrkontroller, i elektroniska termometrar, etc.

Begreppet "nominell kapacitet" används sällan för att karakterisera mangan-zinkbatterier, eftersom deras kapacitet är mycket beroende av driftsförhållanden och förhållanden. De huvudsakliga nackdelarna med dessa element är en betydande spänningsreduktionshastighet genom hela urladdningen och en signifikant minskning av utkapacitansen med ökande urladdningsström. Den slutliga urladdningsspänningen ställs in beroende på belastningen i området 0,7-1,0 V.
Inte bara storleken på urladdningsströmmen är viktig, utan också lastens tidpunkt. Vid intermittenta urladdningar av stora och medelstora strömmar ökar batteriets prestanda markant jämfört med kontinuerlig drift. Men med små urladdningsströmmar och månader av avbrott under drift kan deras kapacitet dock minska till följd av självutladdning.
Grafen ovan visar urladdningskurvorna för ett genomsnittligt saltbatteri under 4, 10, 20 och 40 timmar för jämförelse med en alkalisk, som kommer att diskuteras senare.
Alkaliska (alkaliska) batterier
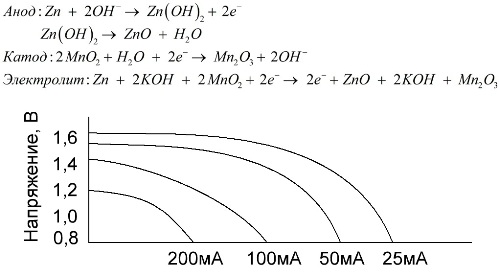
Ett alkaliskt batteri är ett galvaniskt mangan-zinkbatteri, i vilket mangandioxid används som katod, pulveriserat zink används som en anod, och en alkalilösning används som en elektrolyt, vanligtvis i form av en kaliumhydroxidpasta.
Dessa batterier har ett antal fördelar (särskilt en betydligt större kapacitet, bättre prestanda vid låga temperaturer och höga belastningsströmmar).

I jämförelse med saltbatterier kan alkaliska batterier ge mer ström under lång tid. En större ström blir möjlig eftersom zink används här inte i form av ett glas, utan i form av ett pulver med ett större kontaktområde med elektrolyten. Kaliumhydroxid i form av en pasta används som en elektrolyt.
Det är tack vare förmågan hos denna typ av galvaniska celler att leverera en betydande ström (upp till 1 A) under lång tid, är alkaliska batterier vanligast för närvarande.
I elektriska leksaker, i bärbar medicinsk utrustning, i elektroniska apparater, i kameror, används alkaliska batterier överallt. De tjänar 1,5 gånger längre än saltlösning om urladdningen är lågström. Grafen visar urladdningskurvorna vid olika strömmar för jämförelse med ett saltbatteri (diagrammet anges ovan) under 4, 10, 20 och 40 timmar.
Litiumbatterier
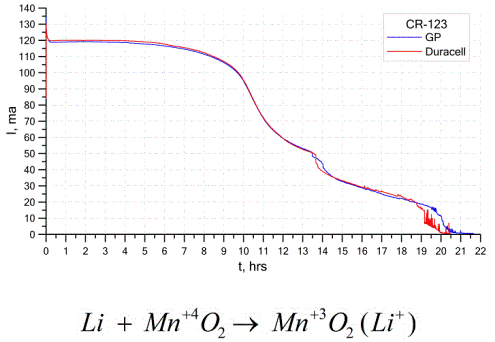
En annan ganska vanlig typ av galvaniska celler är litiumbatterier - enstaka icke-uppladdningsbara galvaniska celler där litium eller dess föreningar används som anod. På grund av användningen av alkalimetall har de en stor potentialskillnad.

Katoden och elektrolyten i en litiumcell kan vara mycket olika, så termen "litiumcell" kombinerar en grupp celler med samma anodmaterial.Som en katod kan till exempel mangandioxid, kolmonofluorid, pyrit, tionylklorid etc. användas.
Litiumbatterier skiljer sig från andra batterier genom deras höga driftstid och höga kostnad. Beroende på storleken och kemiska material som används kan ett litiumbatteri producera spänningar från 1,5 V (kompatibla med alkaliska batterier) till 3,7 V.
Dessa batterier har den högsta kapaciteten per massa och lång hållbarhet. Litiumceller används ofta i modern bärbar elektronisk utrustning: för att driva klockor på datorns moderkort, för att driva bärbara medicinska apparater, klockor, miniräknare, i fotografisk utrustning etc.
Grafen ovan visar urladdningskurvorna för två litiumbatterier från två populära tillverkare. Den initiala strömmen var 120 mA (per motstånd i storleksordningen 24 ohm).
Se även: Moderna uppladdningsbara batterier - fördelar och nackdelar
Se även på elektrohomepro.com
: