kategorier: Nybörjare elektriker, Industriell elektriker
Antal visningar: 37528
Kommentarer till artikeln: 0
Den praktiska tillämpningen av elektrolys
När en elektrisk ström passerar genom en lösning eller en smälta av en elektrolyt, frigörs upplösta elektroder eller andra ämnen som är produkter från sekundära reaktioner på elektroderna på elektroderna. Denna fysisk-kemiska process kallas elektrolys.
Kärnan i elektrolys
I det elektriska fältet som skapas av elektroderna kommer jonerna i ledningsvätskan i en ordnad rörelse. Den negativa elektroden är katoden, den positiva är anoden.
Negativa joner som kallas anjoner (joner av hydroxylgruppen och syrorester) rusar till anoden, och positiva joner som kallas katjoner (väte, metall, ammoniumjoner etc.) rusar till katoden
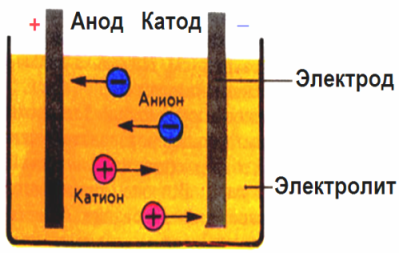
En oxidationsreduktionsprocess äger rum vid elektroderna: elektrokemisk reduktion av partiklar (atomer, molekyler, katjoner) sker vid katoden, och elektrokemisk oxidation av partiklar (atomer, molekyler, anjoner) sker vid anoden. Dissociationreaktioner i en elektrolyt är primära reaktioner, och reaktioner som går direkt vid elektroderna kallas sekundära.
Lagarna i Faraday elektrolys
Separationen av elektrolysreaktioner i primär och sekundär hjälpte Michael Faraday att upprätta elektrolyslagarna:
-
Den första lagen i Faraday-elektrolys: massan av ämnet som avsatts på elektroden under elektrolysen är direkt proportionell mot mängden el som överförs till denna elektrod. Med elmängd menas en elektrisk laddning, mätt som regel i hängsmycken.
-
Faradays elektrolys andra lag: för en viss mängd elektricitet (elektrisk laddning) är massan hos ett kemiskt element som avsatts på elektroden direkt proportionellt mot den ekvivalenta massan för elementet. Ekvivalentmassan för ett ämne är dess molära massa dividerat med ett heltal, beroende på den kemiska reaktionen som ämnet är involverat i.
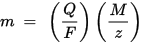
m är massan av ämnet avsatt på elektroden, Q är den totala elektriska laddningen som passerar genom ämnet F = 96,485,33 (83) C mol - 1 är Faraday-konstanten, M är ämnets molära massa (Till exempel den molära massan av vatten H2O = 18 g z är valensantalet för joner av ett ämne (antalet elektroner per jon).
Observera att M / z är ekvivalentmassan för det utfällda ämnet. För den första Faraday-lagen är M, F och z konstanter, så ju större värdet på Q, desto större är värdet på m. För den andra Faraday-lagen är Q, F och z konstanter, så ju större värdet på M / z (ekvivalent massa), desto större är värdet på m.
Elektrolys används i dag inom industri och teknik. Till exempel är det elektrolys som fungerar som en av de mest effektiva metoderna för industriell produktion av väte, väteperoxid, mangandioxid, aluminium, natrium, magnesium, kalcium och andra ämnen. Elektrolys används för att behandla avloppsvatten, elektroplätering, elektroplätering och slutligen i kemiska strömkällor. Men först saker först.
Erhålla rena metaller från malmer genom elektrolys
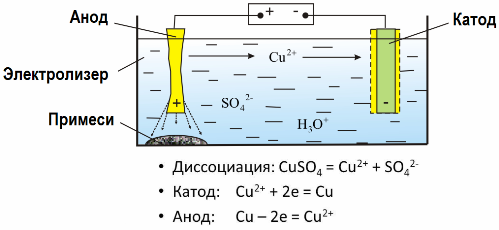
Tack vare elektrolys extraheras många metaller från malmer och utsätts för vidare bearbetning. Så när malm eller anrikat malm - koncentrat - behandlas med reagens, passerar metallen in i lösningen och sedan isoleras metallen från lösningen genom elektroekstraktion. Ren metall släpps samtidigt vid katoden. På detta sätt får zink, koppar, kadmium.
Metaller underkastas elektrodefiniering för att eliminera föroreningar och för att omvandla de innehållade föroreningarna till en form som är lämplig för vidare bearbetning. Metallen som ska rengöras gjutas i form av plattor, och dessa plattor används som anoder i elektrolys.
När strömmen passerar, upplöses anodens metall, passerar i form av katjoner in i lösningen, sedan avges katjonerna vid katoden och bildar en fällning av ren metall. Anodens föroreningar upplöses inte - de fälls ut med anoduppslamningen eller passerar in i elektrolyten, varifrån de kontinuerligt eller periodiskt avlägsnas.
Betrakta som ett exempel kopparelektrefiniering. Huvudkomponenten i lösningen - kopparsulfat - det vanligaste och billigaste saltet av denna metall. Lösningen har låg elektrisk konduktivitet. För att öka den tillsätts svavelsyra till elektrolyten.
Dessutom införs små mängder tillsatser i lösningen för att underlätta bildandet av en kompakt metallutfällning. I allmänhet utsätts koppar, nickel, bly, tenn, silver och guld för elektrolytisk raffinering.
Elektrolysbehandling av avloppsvatten
Elektrolys används vid avloppsrening (processer för elektrokoagulation, elektroekstraktion och elektroflotation). Den elektrokemiska rengöringsmetoden är en av de mest använda. För elektrolys används olösliga anoder (magnetit, blyoxid, grafit, mangan, som är avsatta på en titanbas) eller löslig (aluminium, järn).
Denna metod används för att isolera giftiga organiska och oorganiska ämnen från vatten. Exempelvis rengörs kopparrör i skala med en lösning av svavelsyra, och industriellt avloppsvatten måste sedan rengöras genom elektrolys med en olöslig anod. Koppar släpps vid katoden, som igen kan användas i samma företag.
Alkaliskt avloppsvatten renas genom elektrolys från cyanidföreningar. För att påskynda oxidationen av cyanider, öka den elektriska ledningsförmågan och spara energi används ett tillsatsmedel i form av natriumklorid i vatten.
Elektrolys utförs med en grafitanod och en stålkatod. Cyanider förstörs under elektrokemisk oxidation och klor, som frigörs på anoden. Effektiviteten av sådan rengöring är nära 100%.
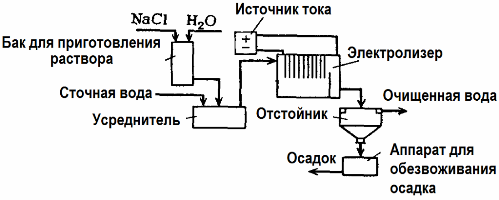
Förutom direkt elektrokemisk rengöring kan den ingå i elektrolysen koagulation. Exklusive tillsats av salter utförs elektrolys med lösliga aluminium- eller järnanoder. Då förstörs inte bara föroreningarna på anoden utan själva anoden upplöses. Aktiva dispergerade föreningar bildas som koagulerar (förtjockar) kolloidala dispergerade föroreningar.
Denna metod är effektiv vid behandling av avloppsvatten från fetter, oljeprodukter, färgämnen, oljor, radioaktiva ämnen, etc. Det kallas elektrokoagulering.
galvanisering
Elektroplätering är elektrolytisk avsättning av vissa metaller för att skydda produkter från korrosion och för att ge dem ett lämpligt estetiskt utseende (beläggning görs med krom, nickel, silver, guld, platina, etc.). Saken rengörs noggrant, avfettas och används som en katod i ett elektrolytiskt bad där en saltlösning av metallen som det är nödvändigt att belägga produkten hälls på.
En platta av samma metall används som anoden. Som regel används ett par anodplattor och föremålet som ska galvaniseras placeras mellan dem.
GALVANOPLASTIK
Elektroplätering - beläggning av metall på ytan av olika kroppar för att återge sina former: formar för gjutning av delar, skulpturer, tryckta klichéer, etc.

Galvanisk avsättning av metall på ytan på ett föremål är endast möjlig när denna yta eller hela föremålet är en elektrisk strömledare, så det är önskvärt att använda metaller för att göra modeller eller former. Smältbara metaller är mest lämpade för detta ändamål: bly, tenn, säljare, trälegering.
Dessa metaller är mjuka, enkelt bearbetade med metallbearbetningsverktyg, är väl graverade och gjutna. Efter uppbyggnad av det galvaniska lagret och efterbehandling smälts formmetallen från den färdiga produkten.
De största möjligheterna för tillverkning av modeller representeras emellertid fortfarande av dielektriska material. För att metallisera sådana modeller är det nödvändigt att ge deras yta elektrisk konduktivitet. Framgång eller misslyckande beror till slut huvudsakligen på kvaliteten på det ledande skiktet. Detta lager kan appliceras på ett av tre sätt.
Det vanligaste sättet är grafitirovanie, det är lämpligt för modeller av modellera och andra material som tillåter slipning av grafit på ytan.
Nästa trick är bronse, metoden är bra för modeller med relativt komplex form, för olika material, men på grund av bronsskiktets tjocklek är överföringen av små delar något förvrängd.
Och slutligen försilvringlämplig i alla fall, men särskilt oumbärlig för bräckliga modeller med en mycket komplex form - växter, insekter etc.
Kemiska strömkällor
Dessutom är elektrolys den huvudsakliga processen på grund av vilken de mest avancerade kemiska strömkällorna, såsom batterier och ackumulatorer, fungerar. Det finns två elektroder i kontakt med elektrolyten.
En potentiell skillnad upprättas mellan elektroderna - en elektromotorisk kraft som motsvarar redoxreaktionens fria energi. Se här för mer information: Kemiska källor till elektrisk ström
Citronbatteri (klicka på bilden för att förstora)
Verkan av kemiska strömkällor baseras på förekomsten av rumsligt separerade processer med en stängd extern krets: på den negativa anoden oxideras reduktionsmedlet, de fria elektronerna som bildas passerar genom den externa kretsen till den positiva katoden, vilket skapar en urladdningsström, där de deltar i oxidationsreduktionsreaktionen. Således går flödet av negativt laddade elektroner längs den externa kretsen från anoden till katoden, det vill säga från den negativa elektroden till den positiva.
Se även på elektrohomepro.com
: