Категорије: Истакнути чланци » Новајлијари
Број прегледа: 70526
Коментари на чланак: 0
Галванске ћелије - уређај, принцип рада, врсте и главне карактеристике
Предуслови за појаву галванских ћелија. Мало историје. 1786. италијански професор медицине, физиолог Луиги Алоисио Галвани открио је занимљиву појаву: мишићи задњих ногу свеже отвореног леша жабе обешени на бакреним кукама уговарали су се када их је научник додирнуо челичним скалпелом. Галвани је одмах закључио да је то манифестација "животињске струје".
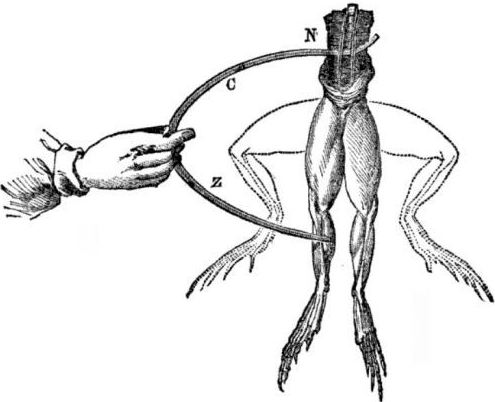
Након Галванијеве смрти, његов савременик Алессандро Волта, као хемичар и физичар, описаће и јавно демонстрира реалнији механизам за појаву електричне струје када различити метали дођу у контакт.
Волта ће, након низа експеримената, доћи до недвосмисленог закључка да се струја појављује у кругу због присуства у њој два проводника различитих метала смештених у течности, а то уопште није "животињска струја", како је Галвани мислио. Трзање ногу жабе било је последица деловања струје која настаје из додира различитих метала (бакрене куке и челични скалпел).
Волта ће показати исте појаве које је Галвани показивао на мртвој жаби, али на потпуно неживом домаћем електрометру, а 1800. године ће дати тачно објашњење струје: „другоразредни проводник (течност) је у средини и у контакту је са два првокласна водича два различита метали ... Као резултат тога настаје електрична струја у једном или другом смеру. "

У једном од првих експеримената, Волта је спустио две плоче - цинк и бакар - у теглу са киселином и повезао их жицом. Након тога, цинкова плоча је почела да се раствара, а на бакарном челику су се формирали гасни мехурићи. Волта је сугерисала и доказала да електрична струја тече кроз жицу.
Тако је изумљен „Волта елемент“ - прва галванска ћелија. Ради практичности, Волта му је дао облик вертикалног цилиндра (стуба), који се састојао од међусобно повезаних прстенова цинка, бакра и тканине импрегниране киселином. Ступ волта висок пола метра створио је напон осетљив на људе.
Од почетка истраживања положио је Луиги Галвани, име хемијски извор струје сачувало је сећање на њега у његово име.
Галванска ћелија Је хемијски извор електричне струје, заснован на интеракцији два метала и / или њихових оксида у електролиту, што доводи до појаве електричне струје у затвореном кругу. Тако се у галванским ћелијама хемијска енергија претвара у електричну.
Ћелије данас

Данас се ћелије називају батерије. Три врсте батерија су распрострањене: физиолошка (сува), алкална (називају се и алкална, „алкална“ у преводу са енглеског - „алкална“) и литијумска. Принцип њиховог рада је исти као што је Волта описао 1800. године: два метала комуницирају преко електролита, а у спољњем затвореном кругу настаје електрична струја.
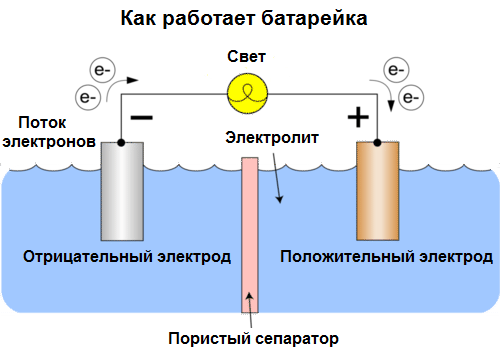
Напон батерије зависи од метала који се користе и од броја ћелија у „батерији“. Батерије, за разлику од батерија, нису способне да поврате своја својства, јер директно претварају хемијску енергију, тј. Енергију реагенса (редуктанта и оксиданса) који чине батерију, у електричну енергију.
Реагенси који су укључени у батерију троше се током њеног рада, струја постепено опада, према томе, деловање извора престаје након што реагенси потпуно реагују.
Алкални и солни елементи (батерије) се широко користе за напајање различитих електронских уређаја, радио опреме, играчака, а литијум се најчешће може наћи у преносним медицинским уређајима као што су мерачи глукозе у крви или у дигиталној технологији, попут камера.

Сочне батерије
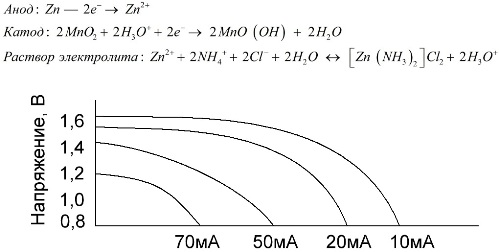
Манган-цинкове ћелије, које се називају батеријама соли, су „суве“ галванске ћелије, унутар којих нема течног електролитног раствора.
Цинк електрода (+) је катода у облику чаше, а прашкаста мешавина мангановог диоксида са графитом служи као анода. Струја тече кроз графитну шипку. Као електролит користи се паста из раствора амонијум-хлорида са додатком шкроба или брашна да се згусне, тако да ништа не тече.
Произвођачи батерија обично не наводе тачан састав елемената соли, међутим, слане батерије су најјефтиније, обично се користе у уређајима где је потрошња енергије изузетно мала: у сатима, на даљинским управљачима, у електронским термометрима итд.

Концепт "номиналног капацитета" ретко се користи за карактеризацију мангано-цинкових батерија, пошто је њихов капацитет у великој мери зависан од радних услова и услова. Главни недостаци ових елемената су значајна стопа смањења напона током пражњења и значајно смањење излазне капацитете с повећањем струје пражњења. Коначни напон пражњења поставља се у зависности од оптерећења у распону од 0,7-1,0 В.
Важна је не само величина струје пражњења, већ и временски распоред оптерећења. Са повременим пражњењем великих и средњих струја, перформансе батерија се знатно повећавају у поређењу са непрекидним радом. Међутим, са малим протоцима пражњења и месечним прекидима у раду, њихов капацитет се може смањити као резултат само-пражњења.
Графикон изнад приказује криве пражњења за просечну батерију соли за 4, 10, 20 и 40 сати за поређење са алкалном, о чему ће бити речи касније.
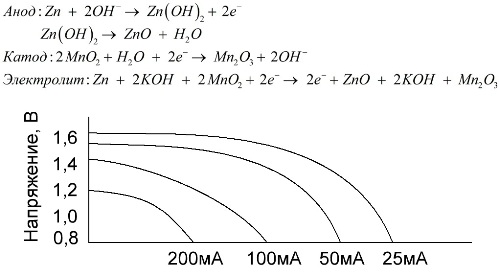
Алкалне (алкалне) батерије
Алкална батерија је галванска батерија од мангана-цинка, у којој се манган диоксид користи као катода, цинк у праху користи се као анода, а алкални раствор се користи као електролит, обично у облику пасте калијум хидроксида.
Ове батерије имају бројне предности (посебно значајно већи капацитет, боље перформансе на ниским температурама и високим струјама оптерећења).

Алкалне батерије, у поређењу са солним, могу дуготрајно давати више струје. Већа струја постаје могућа јер се овде цинк користи не у облику чаше, већ у облику праха који има већу додирну површину са електролитом. Калијум хидроксид у облику пасте користи се као електролит.
Захваљујући способности ове врсте галванских ћелија дуже време испоручују значајну струју (до 1 А), алкалне батерије су тренутно најчешће.
У електричним играчкама, у преносивој медицинској опреми, у електронским уређајима, у фотоапаратима, свугде се користе алкалне батерије. Служе 1,5 пута дуже од физиолошког раствора ако је пражњење мало струје. Графикон приказује кривуље пражњења при различитим струјама за поређење са сланом батеријом (граф је дат горе) током 4, 10, 20 и 40 сати.
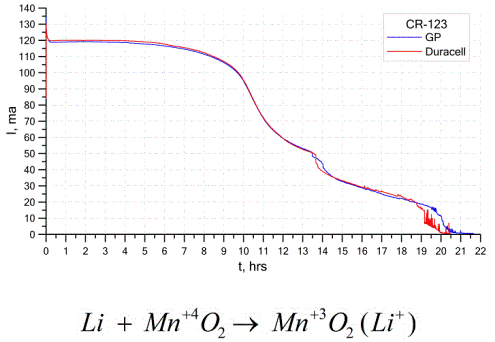
Литијумске батерије
Друга прилично уобичајена врста галванских ћелија су литијумске батерије - појединачне не пуњиве галванске ћелије у којима се литијум или његова једињења користе као анода. Због употребе алкалних метала, они имају велику потенцијалну разлику.

Катода и електролит литијумске ћелије могу бити веома различити, тако да израз „литијумска ћелија“ комбинује групу ћелија са истим материјалом аноде.Као катода могу се користити, на пример, манган диоксид, угљен монофлуорид, пирит, тионил хлорид итд.
Литијумске батерије се од осталих батерија разликују по њиховој високој употреби и високим трошковима. Овисно о одабраној величини и коришћеним хемијским материјалима, литијумска батерија може произвести напон од 1,5 В (компатибилно са алкалним батеријама) до 3,7 В.
Ове батерије имају највећи капацитет по јединици масе и дуг рок трајања. Литијумске ћелије су широко коришћене у савременој преносивој електроничкој опреми: за напајање сата на матичним плочама рачунара, за напајање преносивих медицинских уређаја, сатова, калкулатора, у фотографској опреми итд.
Графикон изнад приказује криве пражњења за две литијумске батерије два популарна произвођача. Почетна струја је била 120 мА (по отпорнику реда 24 Охма).
Погледајте такође: Модерне пуњиве батерије - предности и недостаци
Погледајте и на електрохомепро.цом
: