Категорије: Новајлијари, Индустријски електричар
Број прегледа: 37528
Коментари на чланак: 0
Практична примена електролизе
Када електрична струја прође кроз раствор или талину електролита, растварачи или друге супстанце које су продукти секундарних реакција на електродама ослобађају се на електродама. Овај физикално-хемијски процес назива се електролиза.
Суштина електролизе
У електричном пољу које стварају електроде, јони у проводној течности долазе у одређеном кретању. Негативна електрода је катода, позитивна је анода.
Негативни јони звани аниони (јони хидроксилне групе и киселински остаци) јуре на аноду, а позитивни јони звани катиони (водоник, метал, амонијум јони итд.) Журе каатоди
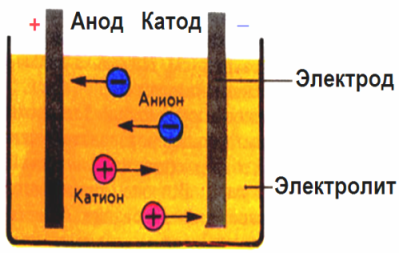
Процес редукције оксидације одвија се на електродама: на катоди долази до електрохемијске редукције честица (атома, молекула, катиона), а на аноди долази до електрохемијске оксидације честица (атома, молекула, аниона). Реакције дисоцијације у електролиту су примарне реакције, а реакције које теку директно на електродама називају се секундарним.
Закони Фарадаиеве електролизе
Раздвајање реакција електролизе на примарне и секундарне помогло је Мицхаелу Фарадаиу да успостави законе електролизе:
-
Први закон Фарадаиеве електролизе: маса материје која се депонује на електроди током електролизе директно је пропорционална количини електричне енергије која се преноси на ову електроду. Под количином електричне енергије подразумева се електрични набој, који се по правилу мери у привесцима.
-
Други закон Фарадаиеве електролизе: за одређену количину електричне енергије (електрични набој) маса хемијског елемента депонованог на електроди је директно пропорционална еквивалентној маси елемента. Еквивалентна маса неке твари је њена моларна маса подијељена с цијелим бројем, зависно од хемијске реакције у којој је супстанца укључена.
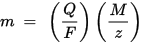
м је маса супстанце депоноване на електроди, К је укупни електрични набој који пролази кроз супстанцу Ф = 96,485.33 (83) Ц мол - 1 је Фарадаиева константа, М је моларна маса материје (На пример, моларна маса воде Х2О = 18 г / мол), з је валенцијски број јона неке супстанце (број електрона по јону).
Имајте на уму да је М / з еквивалентна маса исталожене супстанце. За први Фарадаиев закон М, Ф и з су константе, па што је већа вредност К, већа је вредност м. За други Фарадаиев закон К, Ф и з су константе, па што је већа вредност М / з (еквивалентна маса), већа је и м.
Електролиза се данас широко користи у индустрији и технологији. На пример, електролиза служи као један од најефикаснијих метода за индустријску производњу водоника, водоник-пероксида, манган-диоксида, алуминијума, натријума, магнезијума, калцијума и других супстанци. Електролиза се користи за третирање отпадних вода, галванизирања, галванизирања и коначно у изворима хемијских струја. Али прво ствари.
Добијање чистих метала из руда електролизом
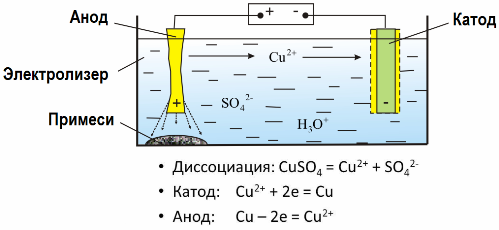
Захваљујући електролизи, многи метали се ваде из руда и подвргавају даљој преради. Дакле, када се руда или обогаћена руда - концентрат - третирају са реагенсима, метал прелази у раствор, а затим се метал екстрахира из раствора електроекстрацијом. Чисти метал се ослобађа на катоди. На овај начин примите цинк, бакар, кадмијум.
Метали су подвргнути електропречишћавању ради уклањања нечистоћа и претварања садржаних нечистоћа у облик погодан за даљу обраду. Метал који се чисти очишћен је у облику плоча, а ове плоче се користе као аноде у електролизи.
Када струја прође, метал аноде се раствара, прелази у облику катиона у раствор, тада се катиони испуштају на катоду и формирају талог од чистог метала. Нечистоће аноде се не растварају - таложе се са суспензијом аноде или прелазе у електролит, одакле се стално или периодично уклањају.
Размотрите као пример бакарно електропречишћавање. Главна компонента раствора - бакар сулфат - најчешћа и најјефтинија со овог метала. Раствор има малу електричну проводљивост. Да бисте га повећали, сумпорна киселина се додаје електролиту.
Поред тога, мале количине адитива се уводе у раствор да би се олакшао стварање компактног металног талога. Опћенито, бакар, никл, олово, коситар, сребро и злато подвргавају се електролитичком рафинирању.
Електролиза Пречишћавање отпадних вода
Електролиза се користи у третману отпадних вода (процеси електрокоагулације, електроекстракције и електрофлотације). Метода електрохемијског чишћења је једна од најчешће коришћених. За електролизу се користе нерастворне аноде (магнетит, оловни оксид, графит, манган, који се таложе на бази титана) или растворљиви (алуминијум, гвожђе).
Ова метода се користи за изоловање токсичних органских и неорганских супстанци из воде. На пример, бакарне цеви се чисте од каменца раствором сумпорне киселине, а индустријске отпадне воде морају се очистити електролизом са нерастворљивом анодом. На катоди се ослобађа бакар који се поново може користити у истом предузећу.
Алкалне отпадне воде се пречишћују електролизом из цијанидних једињења. Да би се убрзала оксидација цијанида, повећала електрична проводљивост и уштедјела енергија, у води се користи адитив у облику натријум-хлорида.
Електролиза се врши графитном анодом и челичном катодом. Цијаниди се уништавају током електрохемијске оксидације и хлора који се ослобађа на аноди. Ефикасност таквог чишћења је близу 100%.
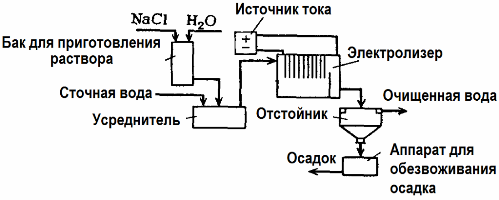
Поред директног електрохемијског чишћења, може се укључити у процес електролизе коагулација. Изузев додавања соли, електролиза се изводи са растворљивим алуминијумским или гвозденим анодама. Тада се уништавају не само контаминанти на аноди, већ се и сама анода раствара. Формирају се активна диспергована једињења која коагулишу (згушњавају) колоидне дисперговане контаминанте.
Ова метода је ефикасна у пречишћавању отпадних вода из масти, нафтних деривата, боја, уља, радиоактивних супстанци итд. Зове се електрокоагулација.
Галванско посуђивање
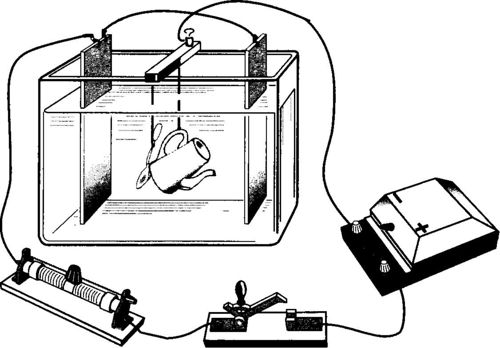
Електроплатирање је електролитичко таложење одређених метала ради заштите производа од корозије и добијања одговарајућег естетског изгледа (премаз је направљен хромом, никлом, сребром, златом, платином итд.). Ствар се темељно чисти, одмашћује и користи као катода у електролитичкој купељи у коју се сипа метални раствор са којим је потребно премазати производ.
Плоча од истог метала користи се као анода. У правилу се користи пар анодних плоча, а предмет који треба поцинчати поставља се између њих.
Електроформинг
Галванско полирање - таложење метала на површини различитих тела како би се репродуковали њихови облици: калупи за ливење делова, скулптуре, штампани клишеи итд.

Наношење галванског метала на површину предмета могуће је само ако је та површина или цео предмет проводник електричне струје, па је за израду модела или облика препоручљиво користити метале. У ту сврху су најприкладнији топљиви метали: олово, калај, лемилице, легура дрвета.
Ови метали су мекани, лако се обрађују алатима за обраду метала, добро су гравирани и ливени. Након накупљања галванског слоја и завршне обраде, метал калупа се раствара из готовог производа.
Међутим, диелектрични материјали и даље представљају највеће могућности за израду модела. Да би се ови модели метализирали, потребно је да дају површинску електричну проводљивост. Успех или неуспех у коначници зависи углавном од квалитета проводног слоја. Овај слој се може нанети на један од три начина.
Најчешћи начин је графизација, погодан је за моделе пластелина и других материјала који омогућавају брушење графита по површини.
Следећи трик је бронзинг, метода је добра за моделе релативно сложеног облика, за различите материјале, међутим, због дебљине бронзаног слоја, пренос ситних детаља је донекле поремећен.
И коначно сребропогодан у свим случајевима, али посебно неопходан за крхке моделе врло сложеног облика - биљке, инсекте итд.
Хемијски извори струје
Такође, електролиза је главни процес због којег функционишу најмодернији хемијски извори струје, попут батерија и акумулатора. Постоје две електроде у контакту са електролитом.
Поставља се потенцијална разлика између електрода - електромоторне силе која одговара слободној енергији редокс реакције. Погледајте овде за више детаља: Хемијски извори електричне струје
Лимунска батерија (кликните на слику за повећање)
Деловање извора хемијских струја заснива се на појави просторно раздвојених процеса са затвореним спољашњим кругом: на негативној аноди редукционо средство оксидира, слободни електрони који се формирају пролазе кроз спољни круг до позитивног катода, стварајући струју пражњења, где учествују у реакцији смањења оксидације. Дакле, проток негативно набијених електрона дуж спољног круга прелази из аноде у катоду, односно из негативне електроде у позитивну.
Погледајте и на електрохомепро.цом
: