categorii: Electricieni novici, Electrician industrial
Număr de vizualizări: 37528
Comentarii la articol: 0
Aplicarea practică a electrolizei
Când un curent electric trece printr-o soluție sau o topire de electroliți, soluții sau alte substanțe care sunt produse ale reacțiilor secundare ale electrozilor sunt eliberate pe electrozi. Acest proces fizico-chimic se numește electroliză.
Esența electrolizei
În câmpul electric creat de electrozi, ionii din fluidul conductor vin într-o mișcare ordonată. Electrodul negativ este catodul, pozitivul este anodul.
Ionii negativi numiți anioni (ioni ai grupării hidroxil și reziduuri acide) se îndreaptă spre anod, iar ionii pozitivi numiți cationi (hidrogen, metal, ioni de amoniu etc.) se grăbesc spre catod.
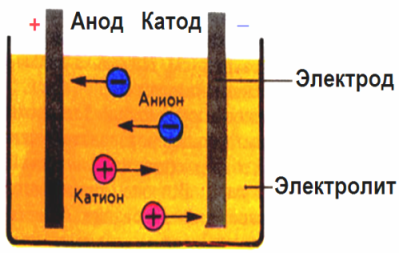
La electrozi are loc un proces de oxidare-reducere: reducerea electrochimică a particulelor (atomi, molecule, cationi) are loc la catod, iar oxidarea electrochimică a particulelor (atomi, molecule, anioni) are loc la anod. Reacțiile de disociere într-un electrolit sunt reacții primare, iar reacțiile care se desfășoară direct la electrozi sunt numite secundare.
Legile electrolizei Faraday
Separarea reacțiilor de electroliză în primară și secundară l-a ajutat pe Michael Faraday să stabilească legile electrolizei:
-
Prima lege a electrolizei lui Faraday: masa substanței depozitate pe electrod în timpul electrolizei este direct proporțională cu cantitatea de electricitate transferată acestui electrod. Prin cantitatea de energie electrică se înțelege o sarcină electrică, măsurată, de regulă, în pandantive.
-
A doua lege a electrolizei Faraday: pentru o cantitate dată de energie electrică (sarcină electrică), masa unui element chimic depus pe electrod este direct proporțională cu masa echivalentă a elementului. Masa echivalentă a unei substanțe este masa sa molară divizată la un număr întreg, în funcție de reacția chimică în care este implicată substanța.
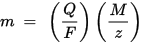
m este masa substanței depuse pe electrod, Q este sarcina electrică totală care trece prin substanța F = 96,485,33 (83) C mol - 1 este constanta Faraday, M este masa molară a substanței (De exemplu, masa molară a apei H2O = 18 g / mol), z este numărul de valență al ionilor unei substanțe (numărul de electroni per ion).
Rețineți că M / z este masa echivalentă a substanței precipitate. Pentru prima lege Faraday, M, F și z sunt constante, deci cu cât valoarea Q este mai mare, cu atât valoarea lui m este mai mare. Pentru a doua lege Faraday, Q, F și z sunt constante, deci cu cât valoarea M / z (masă echivalentă) este mai mare, cu atât este mai mare valoarea lui m.
Electroliza este larg utilizată astăzi în industrie și în tehnologie. De exemplu, electroliza servește ca una dintre cele mai eficiente metode pentru producția industrială de hidrogen, peroxid de hidrogen, dioxid de mangan, aluminiu, sodiu, magneziu, calciu și alte substanțe. Electroliza este utilizată pentru tratarea apelor uzate, în electroplacare, în galvanizare și în final în surse de curent chimic. Dar primele lucruri în primul rând.
Obținerea de metale pure din minereuri prin electroliză
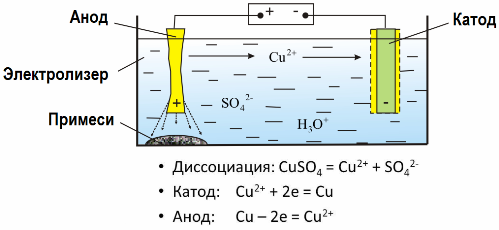
Datorită electrolizei, multe metale sunt extrase din minereuri și supuse prelucrării ulterioare. Deci, când minereul sau minereul îmbogățit - concentrat - este tratat cu reactivi, metalul trece în soluție, apoi metalul este extras din soluție prin electroextracție. Metalul pur este eliberat în același timp la catod. În acest fel, primiți zinc, cupru, cadmiu.
Metalele sunt supuse electrorefinirii pentru a elimina impuritățile și pentru a transforma impuritățile conținute într-o formă convenabilă pentru prelucrarea ulterioară. Metalul care trebuie curățat este turnat sub formă de plăci, iar aceste plăci sunt utilizate ca anodi în electroliză.
Când curentul trece, metalul anodului se dizolvă, trece sub formă de cationi în soluție, apoi cationii sunt descărcați la catod și formează un precipitat de metal pur. Impuritățile anodului nu se dizolvă - se precipită cu suspensia anodică sau trec în electrolit, de unde sunt îndepărtate continuu sau periodic.
Luați în considerare un exemplu cupru electrorefinare. Componenta principală a soluției - sulfat de cupru - cea mai comună și mai ieftină sare a acestui metal. Soluția are o conductivitate electrică scăzută. Pentru a-l crește, se adaugă acid sulfuric în electrolit.
În plus, în soluție sunt introduse cantități mici de aditivi pentru a facilita formarea unui precipitat metalic compact. În general, cupru, nichel, plumb, staniu, argint și aur sunt supuse rafinării electrolitice.
Electroliză Tratarea apelor uzate
Electroliza este utilizată în tratarea apelor uzate (procese de electrocoagulare, electroextracție și electroflotație). Metoda de curățare electrochimică este una dintre cele mai utilizate. Pentru electroliză, se folosesc anoduri insolubile (magnetită, oxid de plumb, grafit, mangan, care sunt depuse pe o bază de titan) sau solubile (aluminiu, fier).
Această metodă este utilizată pentru a izola substanțele organice toxice și anorganice de apă. De exemplu, conductele de cupru sunt curățate la scară cu o soluție de acid sulfuric, iar apa uzată industrială trebuie apoi curățată prin electroliză cu un anod insolubil. Cuprul este eliberat la catod, care poate fi din nou utilizat în aceeași întreprindere.
Apele uzate alcaline sunt purificate prin electroliză din compuși cianuri. Pentru a accelera oxidarea cianurilor, a crește conductivitatea electrică și a economisi energie, în apă se folosește un aditiv sub formă de clorură de sodiu.
Electroliza se realizează cu un anod grafit și un catod din oțel. Cianurile sunt distruse în timpul oxidării electrochimice și a clorului, care este eliberat pe anod. Eficiența unei astfel de curățări este aproape de 100%.
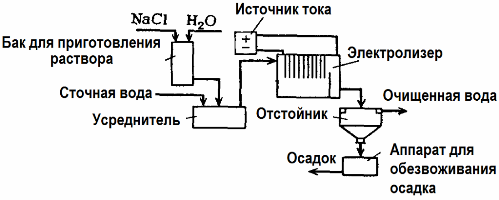
Pe lângă curățarea electrochimică directă, aceasta poate fi inclusă în procesul de electroliză coagulare. Cu excepția adăugării de săruri, electroliza se realizează cu anoduri solubile din aluminiu sau fier. Apoi, nu numai contaminanții de pe anod sunt distruși, dar anodul în sine se dizolvă. Se formează compuși dispersi activi care coagulează (se îngroașă) contaminanții dispersi coloidali.
Această metodă este eficientă în tratarea apelor uzate din grăsimi, produse petroliere, coloranți, uleiuri, substanțe radioactive etc. Se numește electrocoagulare.
galvanizarea
Placarea este depunerea electrolitică a anumitor metale pentru a proteja produsele de coroziune și pentru a le conferi un aspect estetic adecvat (acoperirea este realizată cu crom, nichel, argint, aur, platină etc.). Lucrul este curățat complet, degresat și folosit ca catod într-o baie electrolitică în care este turnată o soluție de sare a metalului cu care este necesară acoperirea produsului.
O placă din același metal este utilizată ca anod. De regulă, se utilizează o pereche de plăci anodice, iar subiectul care trebuie galvanizat este plasat între ele.
galvanoplastie
Galvanizare - depunerea metalului pe suprafața diferitelor corpuri pentru a-și reproduce formele: matrițe pentru piese turnate, sculpturi, clicuri imprimate etc.

Depunerea galvanică a metalului pe suprafața unui obiect este posibilă numai atunci când această suprafață sau întregul obiect este un conductor de curent electric, de aceea este indicat să folosiți metale pentru a realiza modele sau forme. Metalele fuzibile sunt cele mai potrivite în acest scop: plumb, staniu, lipituri, aliaj de lemn.
Aceste metale sunt moi, ușor prelucrate cu unelte pentru prelucrarea metalelor, sunt bine gravate și turnate. După construirea stratului galvanic și finisarea, metalul matriței este topit din produsul finit.
Cu toate acestea, cele mai mari oportunități pentru fabricarea modelelor sunt încă reprezentate de materialele dielectrice. Pentru a metaliza astfel de modele, este necesar să le confere conductivitate electrică de suprafață. Succesul sau eșecul depinde în cele din urmă de calitatea stratului conductor. Acest strat poate fi aplicat într-unul din cele trei moduri.
Cea mai comună cale este grafitirovanie, este potrivit pentru modele de plastilină și alte materiale care permit măcinarea grafitului la suprafață.
Următorul truc este bronzare, metoda este bună pentru modele de formă relativ complexă, pentru diferite materiale, totuși, datorită grosimii stratului de bronz, transferul pieselor mici este oarecum distorsionat.
Și în sfârșit argintareadecvat în toate cazurile, dar îndeosebi indispensabil modelelor fragile cu o formă foarte complexă - plante, insecte etc.
Surse de curent chimic
De asemenea, electroliza este principalul proces datorită căruia funcționează cele mai avansate surse de curent chimic, cum ar fi bateriile și acumulatorii. Există doi electrozi în contact cu electrolitul.
O diferență de potențial este stabilită între electrozi - o forță electromotivă corespunzătoare energiei libere a reacției redox. Vezi aici pentru mai multe detalii: Surse chimice de curent electric
Baterie cu lămâie (faceți clic pe imagine pentru a mări)
Acțiunea surselor de curent chimic se bazează pe apariția proceselor separate spațial cu un circuit extern închis: pe anodul negativ, agentul reducător este oxidat, electronii liberi care se formează trec prin circuitul extern către catodul pozitiv, creând un curent de descărcare, unde participă la reacția de reducere a oxidării. Astfel, fluxul de electroni încărcați negativ de-a lungul circuitului extern merge de la anod la catod, adică de la electrodul negativ la cel pozitiv.
Consultați și la i.electricianexp.com
: