Kategorie: Początkujący elektrycy, Elektryk przemysłowy
Liczba wyświetleń: 37528
Komentarze do artykułu: 0
Praktyczne zastosowanie elektrolizy
Kiedy prąd elektryczny przepływa przez roztwór lub stop elektrolitu, substancje rozpuszczone lub inne substancje, które są produktami wtórnych reakcji na elektrodach, uwalniają się na elektrodach. Ten proces fizykochemiczny nazywa się elektrolizą.
Istota elektrolizy
W polu elektrycznym wytwarzanym przez elektrody jony w płynie przewodzącym poruszają się w uporządkowany sposób. Elektroda ujemna jest katodą, dodatnia jest anodą.
Jony ujemne zwane anionami (jony grupy hydroksylowej i reszt kwasowych) pędzą do anody, a jony dodatnie zwane kationami (wodór, jony metali, jonów amonowych itp.) Pędzą do katody
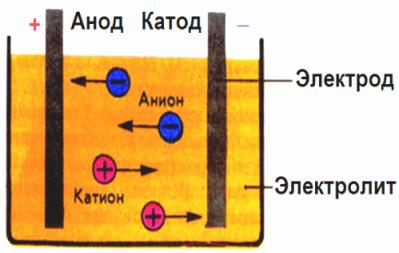
Na elektrodach zachodzi proces utleniania i redukcji: elektrochemiczna redukcja cząstek (atomów, cząsteczek, kationów) zachodzi na katodzie, a elektrochemiczne utlenianie cząstek (atomów, cząsteczek, anionów) zachodzi na anodzie. Reakcje dysocjacji w elektrolicie są reakcjami pierwotnymi, a reakcje przebiegające bezpośrednio na elektrodach nazywane są wtórnymi.
Prawa elektrolizy Faradaya
Rozdzielenie reakcji elektrolizy na pierwotną i wtórną pomogło Michaelowi Faradayowi ustalić prawa elektrolizy:
-
Pierwsza zasada elektrolizy Faradaya: masa substancji osadzonej na elektrodzie podczas elektrolizy jest wprost proporcjonalna do ilości elektryczności przenoszonej na tę elektrodę. Przez ilość energii elektrycznej rozumie się ładunek elektryczny, mierzony z reguły w wisiorkach.
-
Drugie prawo elektrolizy Faradaya: dla danej ilości elektryczności (ładunku elektrycznego) masa pierwiastka chemicznego osadzonego na elektrodzie jest wprost proporcjonalna do równoważnej masy pierwiastka. Równoważna masa substancji to jej masa molowa podzielona przez liczbę całkowitą, w zależności od reakcji chemicznej, w której bierze udział substancja.
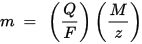
m jest masą substancji osadzonej na elektrodzie, Q jest całkowitym ładunkiem elektrycznym przechodzącym przez substancję F = 96.485,33 (83) C mol - 1 jest stałą Faradaya, M jest masą molową substancji (Na przykład masa molowa wody H2O = 18 g / mol), z jest liczbą walencyjną jonów substancji (liczba elektronów na jon).
Należy zauważyć, że M / z jest równoważną masą wytrąconej substancji. Dla pierwszego prawa Faradaya M, F i z są stałymi, więc im większa wartość Q, tym większa wartość m. Dla drugiego prawa Faradaya Q, F i z są stałymi, więc im większa wartość M / z (masa równoważna), tym większa wartość m.
Elektroliza jest dziś szeroko stosowana w przemyśle i technologii. Na przykład elektroliza służy jako jedna z najbardziej skutecznych metod przemysłowej produkcji wodoru, nadtlenku wodoru, dwutlenku manganu, glinu, sodu, magnezu, wapnia i innych substancji. Elektroliza jest stosowana do oczyszczania ścieków, w galwanizacji, w galwanizacji, a na końcu w źródłach prądu chemicznego. Ale przede wszystkim.
Otrzymywanie czystych metali z rud poprzez elektrolizę
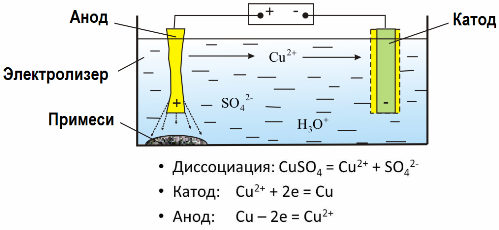
Dzięki elektrolizie wiele metali jest wydobywanych z rud i poddawanych dalszej obróbce. Tak więc, gdy rudę lub wzbogaconą rudę - koncentrat - traktuje się odczynnikami, metal przechodzi do roztworu, a następnie metal jest ekstrahowany z roztworu przez ekstrakcję elektryczną. Czysty metal jest uwalniany w tym samym czasie na katodzie. W ten sposób otrzymujesz cynk, miedź, kadm.
Metale poddaje się elektrorafinacji w celu wyeliminowania zanieczyszczeń i przekształcenia zawartych zanieczyszczeń w formę dogodną do dalszego przetwarzania. Metal, który ma być czyszczony, jest odlewany w postaci płytek, które są wykorzystywane jako anody w elektrolizie.
Gdy prąd przepływa, metal anodowy rozpuszcza się, przechodzi w postaci kationów do roztworu, a następnie kationy są rozładowywane na katodzie i tworzą osad czystego metalu. Zanieczyszczenia anody nie rozpuszczają się - wytrącają się z zawiesiną anody lub przechodzą do elektrolitu, skąd są w sposób ciągły lub okresowo usuwane.
Rozważ jako przykład elektrorafinacja miedzi. Główny składnik roztworu - siarczan miedzi - najczęstsza i najtańsza sól tego metalu. Rozwiązanie ma niską przewodność elektryczną. Aby go zwiększyć, do elektrolitu dodaje się kwas siarkowy.
Ponadto do roztworu wprowadza się niewielkie ilości dodatków, aby ułatwić tworzenie zwartego osadu metalu. Ogólnie miedź, nikiel, ołów, cyna, srebro i złoto są poddawane rafinacji elektrolitycznej.
Elektroliza Oczyszczanie ścieków
Elektroliza jest stosowana w oczyszczaniu ścieków (procesy elektrokoagulacji, elektroekstrakcji i elektroflotacji). Elektrochemiczna metoda czyszczenia jest jedną z najczęściej stosowanych. Do elektrolizy stosuje się nierozpuszczalne anody (magnetyt, tlenek ołowiu, grafit, mangan, które osadzają się na bazie tytanu) lub rozpuszczalne (aluminium, żelazo).
Ta metoda służy do izolowania toksycznych substancji organicznych i nieorganicznych z wody. Na przykład rury miedziane oczyszcza się z kamienia za pomocą roztworu kwasu siarkowego, a ścieki przemysłowe należy następnie oczyścić przez elektrolizę nierozpuszczalną anodą. Miedź jest uwalniana na katodzie, którą można ponownie wykorzystać w tym samym przedsiębiorstwie.
Ścieki alkaliczne są oczyszczane przez elektrolizę ze związków cyjanku. W celu przyspieszenia utleniania cyjanków, zwiększenia przewodności elektrycznej i oszczędności energii w wodzie stosuje się dodatek w postaci chlorku sodu.
Elektrolizę przeprowadza się za pomocą anody grafitowej i stalowej katody. Cyjanki ulegają zniszczeniu podczas utleniania elektrochemicznego i chloru uwalnianego na anodzie. Skuteczność takiego czyszczenia jest bliska 100%.
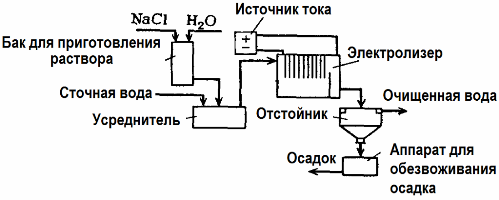
Oprócz bezpośredniego czyszczenia elektrochemicznego można go włączyć do procesu elektrolizy koagulacja. Wyłączając dodawanie soli, elektrolizę przeprowadza się za pomocą rozpuszczalnych anod aluminiowych lub żelaznych. Wtedy nie tylko zanieczyszczenia na anodzie są niszczone, ale sama anoda rozpuszcza się. Powstają aktywne zdyspergowane związki, które koagulują (zagęszczają) koloidalne zdyspergowane zanieczyszczenia.
Ta metoda jest skuteczna w oczyszczaniu ścieków z tłuszczów, produktów ropopochodnych, barwników, olejów, substancji radioaktywnych itp. Nazywa się to elektrokoagulacją.
Galwanizacja
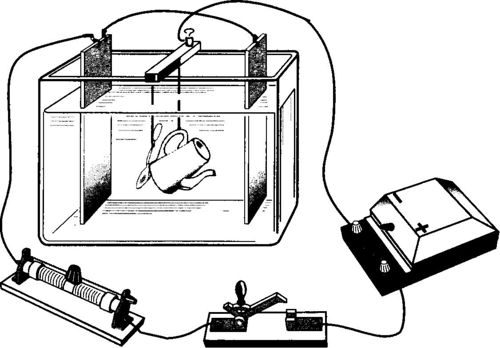
Galwanizacja polega na elektrolitycznym osadzaniu niektórych metali w celu ochrony produktów przed korozją i nadania im odpowiedniego wyglądu estetycznego (powłoka wykonana jest z chromu, niklu, srebra, złota, platyny itp.). Przedmiot jest dokładnie czyszczony, odtłuszczany i stosowany jako katoda w kąpieli elektrolitycznej, w której wlewa się roztwór soli metalu, którym konieczne jest pokrycie produktu.
Jako anodę zastosowano płytkę z tego samego metalu. Z reguły stosuje się parę płytek anodowych, a przedmiot do ocynkowania umieszcza się między nimi.
Formowanie elektryczne
Galwanizacja - osadzanie metalu na powierzchni różnych ciał w celu odtworzenia ich kształtów: formy do odlewania części, rzeźby, drukowane klisze itp.

Galwaniczne osadzanie metalu na powierzchni obiektu jest możliwe tylko wtedy, gdy ta powierzchnia lub cały obiekt jest przewodnikiem prądu elektrycznego, dlatego zaleca się stosowanie metali do tworzenia modeli lub form. Do tego celu najlepiej nadają się topliwe metale: ołów, cyna, lutowie, stop drewna.
Metale te są miękkie, łatwe do obróbki za pomocą narzędzi do obróbki metali, są dobrze grawerowane i odlewane. Po nałożeniu warstwy galwanicznej i wykończeniu metal formy wytapia się z gotowego produktu.
Jednak największe możliwości wytwarzania modeli są nadal reprezentowane przez materiały dielektryczne. Aby metalizować takie modele, konieczne jest podanie przewodności elektrycznej ich powierzchni. Sukces lub porażka ostatecznie zależy głównie od jakości warstwy przewodzącej. Tę warstwę można nakładać na jeden z trzech sposobów.
Najczęstszym sposobem jest grafityzacja, nadaje się do modeli z plasteliny i innych materiałów, które umożliwiają szlifowanie grafitu na powierzchni.
Następna sztuczka to brązującymetoda ta jest dobra dla modeli o stosunkowo złożonym kształcie, dla różnych materiałów, jednak ze względu na grubość warstwy brązu przenoszenie drobnych szczegółów jest nieco zniekształcone.
I wreszcie srebrzenieodpowiedni we wszystkich przypadkach, ale szczególnie niezbędny w przypadku delikatnych modeli o bardzo złożonym kształcie - roślin, owadów itp.
Chemiczne źródła prądu
Ponadto elektroliza jest głównym procesem, dzięki któremu funkcjonują najnowocześniejsze źródła prądu chemicznego, takie jak baterie i akumulatory. Dwie elektrody stykają się z elektrolitem.
Różnica potencjałów jest ustalana między elektrodami - siła elektromotoryczna odpowiadająca swobodnej energii reakcji redoks. Zobacz tutaj po więcej szczegółów: Chemiczne źródła prądu elektrycznego
Akumulator cytrynowy (kliknij na zdjęcie, aby powiększyć)
Działanie źródeł prądu chemicznego opiera się na występowaniu przestrzennie oddzielonych procesów z zamkniętym obwodem zewnętrznym: na anodzie ujemnej utleniacz jest redukowany, powstałe wolne elektrony przechodzą przez obwód zewnętrzny do katody dodatniej, tworząc prąd rozładowania, w którym uczestniczą w reakcji redukcji utleniania. Tak więc przepływ ujemnie naładowanych elektronów wzdłuż obwodu zewnętrznego przechodzi od anody do katody, to znaczy od elektrody ujemnej do dodatniej.
Zobacz także na bgv.electricianexp.com
: