Kategori: Artikel Pilihan » Novice juruelektrik
Bilangan pandangan: 36288
Komen pada artikel: 1
Sumber semasa kimia: ciri-ciri utama
 Selama lebih dari dua abad, manusia telah menggunakan tenaga tindak balas kimia antara pelbagai bahan untuk menghasilkan arus terus.
Selama lebih dari dua abad, manusia telah menggunakan tenaga tindak balas kimia antara pelbagai bahan untuk menghasilkan arus terus.
Prinsip kerja
Reaksi redoks yang berlaku di antara bahan dengan sifat-sifat agen pengoksidaan dan agen pengurangan disertai dengan pembebasan elektron, pergerakan yang membentuk arus elektrik. Walau bagaimanapun, untuk menggunakan tenaganya, adalah perlu untuk mewujudkan keadaan bagi laluan elektron melalui litar luaran; jika tidak, ia dilepaskan oleh haba dari campuran mudah dari suatu agen pengoksidaan dan ejen pengurangan.
Oleh itu, semua sumber semasa kimia mempunyai dua elektrod:
-
anod di mana pengoksidaan berlaku;
-
katod, menjalankan pemulihan bahan itu.
Elektrod pada jarak diletakkan di dalam sebuah kapal dengan elektrolit - suatu bahan yang menjalankan arus elektrik disebabkan proses pemisahan medium ke dalam ion.
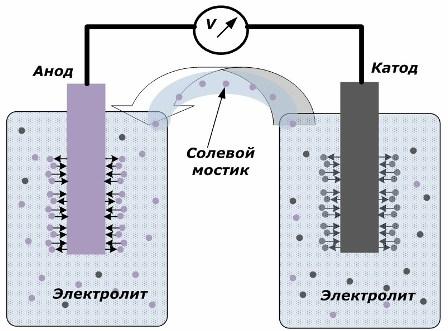
Prinsip menukar tenaga kimia menjadi tenaga elektrik
Angka ini menunjukkan bahawa elektrod diletakkan di dalam kapal berasingan yang dihubungkan oleh jambatan garam di mana pergerakan ion di sepanjang litar dalaman dibuat. Apabila litar luaran dan dalaman terbuka, dua proses berlaku pada elektrod: peralihan ion dari logam elektrod ke elektrolit dan peralihan ion dari elektrolit ke kekisi kristal elektrod.
Kadar aliran proses ini adalah sama dan potensi voltan tanda bertentangan terkumpul pada setiap elektrod. Jika ia disambungkan melalui jambatan garam dan beban dikenakan, litar elektrik akan berlaku. Arus dalaman dihasilkan oleh pergerakan ion antara elektrod melalui elektrolit dan jambatan garam. Pergerakan elektron di sepanjang litar luar dalam arah dari anoda ke katod.
Hampir semua reaksi redoks disertai dengan penjanaan elektrik. Tetapi nilainya bergantung kepada banyak faktor, termasuk jumlah dan jisim bahan kimia yang digunakan, bahan yang digunakan untuk membuat elektrod, seperti elektrolit, kepekatan ion, reka bentuk.
Yang paling banyak digunakan dalam sumber-sumber semasa kimia moden ialah:
-
untuk bahan anod (agen pengurangan) - zink (Zn), plumbum (Pb), kadmium (Cd) dan beberapa logam lain;
-
untuk bahan katod (oxidizer) - plumbum oksida PbO2, mangan oksida MnO2, nikel hidroksida NiOOH dan lain-lain;
-
elektrolit berdasarkan penyelesaian asid, alkali atau garam.
Kaedah Klasifikasi
Satu bahagian sumber kuasa kimia boleh digunakan semula, manakala yang lain tidak boleh. Prinsip ini diambil sebagai asas klasifikasi mereka.
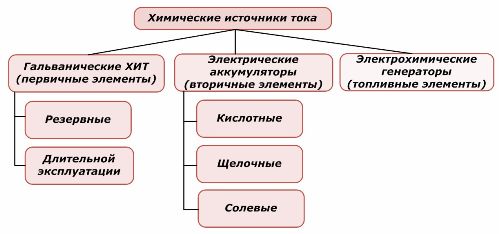
Klasifikasi unsur-unsur kimia
Kuasa elektromotif sel galvanik, bergantung kepada reka bentuk, mencapai 1.2 ÷ 1.5 volt. Untuk mendapatkan nilai yang besar, ia digabungkan menjadi bateri, menyambung secara siri. Apabila bateri disambung secara selari, arus dan kuasa meningkat.
Secara amnya diterima bahawa sumber semasa kimia utama tidak menyokong pengisian, walaupun lebih tepatnya kedudukan ini dapat dirumuskan secara berlainan: pelaksanaannya tidak dapat dilaksanakan secara ekonomi.
Sumber arus kimia utama yang redundant disimpan di dalam keadaan di mana elektrolit diasingkan daripada elektrod. Ini menghapuskan reaksi redoks dan memastikan kesediaan untuk pentauliahan. Mereka tidak digunakan semula. Hayat simpanan bahan kuasa sandaran kimia adalah terhad kepada 10-15 tahun.
Bateri berjaya diisi semula dengan penggunaan tenaga elektrik luaran. Oleh kerana ciri ini, mereka dipanggil sumber semasa sekunder. Mereka mampu bertahan beratus-ratus dan beribu-ribu kitaran pelepasan caj.EMF bateri boleh berada dalam lingkungan 1.0 ÷ 1.5 volt. Mereka juga digabungkan menjadi bateri.
Penjana elektrokimia bekerja pada prinsip sel galvanik, tetapi mereka membawa bahan dari luar untuk melakukan tindak balas elektrokimia, dan semua produk yang dikeluarkan dikeluarkan dari elektrolit. Ini membolehkan anda mengatur proses yang berterusan.
Ciri-ciri prestasi utama sumber kuasa kimia
1. Voltan merentas terminal terbuka
Bergantung kepada reka bentuk, satu sumber hanya dapat menghasilkan perbezaan potensi tertentu. Untuk digunakan dalam peranti elektrik, ia digabungkan menjadi bateri.
2. Keupayaan khusus
Untuk masa tertentu (dalam jam) satu sumber arus kimia boleh menjana sejumlah arus (amperes) yang terhad, yang dikaitkan dengan unit berat atau kelantangan.
3. Ketumpatan kuasa
Ia mencirikan keupayaan unit berat atau isipadu sumber arus kimia untuk menjana kuasa yang dihasilkan oleh produk voltan oleh kekuatan semasa.
4. Tempoh operasi
Parameter ini juga dipanggil tarikh tamat tempoh.
5. Nilai arus pelepasan diri
Proses sampingan tindak balas elektrokimia ini membawa kepada penggunaan jisim aktif unsur-unsur, menyebabkan kakisan, dan mengurangkan kapasiti tertentu.
6. Harga produk
Bergantung pada reka bentuk, bahan yang digunakan dan beberapa faktor lain.
Sumber-sumber semasa kimia yang paling baik adalah mereka yang mempunyai nilai tinggi empat parameter pertama, dan pelepasan diri dan kos rendah.
Prinsip Pengecasan Bateri
Di antara sumber semasa kimia sekunder, mereka semakin popular. model ion lithium, yang telah digunakan secara meluas untuk mengawal peranti elektronik. Mereka menggunakan LiMO2 (M Co, Ni, Mn) sebagai bahan elektrod positif, dan grafit sebagai elektrod negatif.
Apabila dikenakan, ion litium dari tenaga luaran yang digunakan dilepaskan dari logam katod, melalui elektrolit dan menembusi ruang antara lapisan grafit, terkumpul di sana.
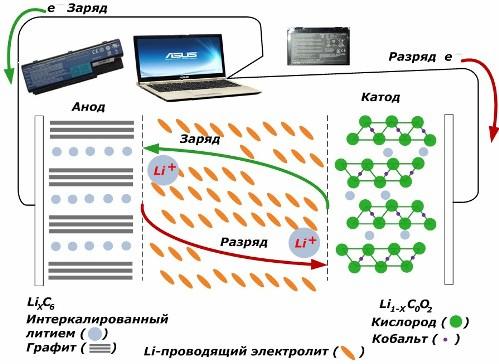
Apabila tenaga pengecas tidak hadir, dan beban disambungkan kepada elektrod, maka ion lithium dalam elektrolit bergerak ke arah yang bertentangan.
Jika caj dan pelepasan tidak dijalankan, maka tenaga dalam bateri tidak digunakan, tetapi disimpan. Tetapi jumlahnya terhad oleh sifat-sifat bahan yang digunakan. Contohnya, dalam bateri lithium-ion, kapasiti elektrik tertentu ialah 130 ÷ 150 mAh / g. Ia adalah terhad oleh sifat-sifat bahan anod. Bagi grafit, kapasiti kira-kira dua kali lebih tinggi.
Para saintis kini sedang mencari cara untuk meningkatkan kapasiti bateri, sedang meneroka kemungkinan menggunakan tindak balas kimia antara litium dan oksigen di udara. Untuk melakukan ini, reka bentuk dibangunkan dengan udara, katod yang tidak dibelanjakan, digunakan dalam bateri berasingan. Kaedah ini dapat meningkatkan kepadatan tenaga sehingga 10 kali.
Pengendalian sumber semasa kimia memerlukan pengetahuan asas kejuruteraan elektrik, elektrokimia, sains bahan dan fizik keadaan pepejal.
Lihat juga di i.electricianexp.com
:
