категории: Препоръчани статии » Новаци електротехници
Брой преглеждания: 36288
Коментари към статията: 1
Химически източници на ток: основни характеристики
 Повече от два века човечеството използва енергията на химичните реакции между различни вещества, за да произвежда постоянен ток.
Повече от два века човечеството използва енергията на химичните реакции между различни вещества, за да произвежда постоянен ток.
Принцип на работа
Редукционната реакция, възникваща между вещества със свойствата на окислител и редуциращ агент, се придружава от отделяне на електрони, движението на които образува електрически ток. Въпреки това, за да се използва неговата енергия, е необходимо да се създадат условия за преминаване на електрони през външна верига, в противен случай той се освобождава във външната среда чрез просто смесване на окислителя и редуциращия агент с топлина.
Следователно, всички химически източници на ток имат два електрода:
-
анода, на който се извършва окисляването;
-
катод, извършвайки възстановяването на веществото.
Електроди на разстояние се поставят в съд с електролит - вещество, което провежда електрически ток поради процесите на дисоциация на средата в йони.
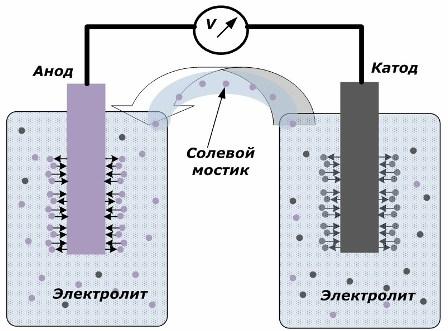
Принципът на превръщане на химическата енергия в електрическа
Фигурата показва, че електродите са поставени в отделни съдове, свързани чрез солен мост, през който се създава движението на йони по вътрешната верига. Когато външната и вътрешната верига са отворени, на електродите се случват два процеса: преходът на йони от метала на електрода към електролита и преходът на йони от електролита към кристалната решетка на електродите.
Дебитите на тези процеси са еднакви и потенциалите на напрежението на противоположни знаци се натрупват на всеки електрод. Ако те са свързани чрез солен мост и се прилага товар, ще възникне електрическа верига. Вътрешен ток се генерира от движението на йони между електродите през електролита и солевия мост. Движението на електрони по външната верига в посока от анода към катода.
Почти всички редокс-реакции са придружени от производство на електричество. Но стойността му зависи от много фактори, включително обемите и масите на използваните химикали, материалите, използвани за направата на електродите, като електролит, концентрация на йони, дизайн.
Най-широко използваните в съвременните химически източници на ток са:
-
за материала на анода (редуциращ агент) - цинк (Zn), олово (Pb), кадмий (Cd) и някои други метали;
-
за катодния материал (окислител) - оловен оксид PbO2, манганов оксид MnO2, никелов хидроксид NiOOH и други;
-
електролити на базата на разтвори на киселини, основи или соли.
Методи за класификация
Една част от химическите източници на енергия може да се използва повторно, докато другата не може. Този принцип е взет като основа за тяхната класификация.
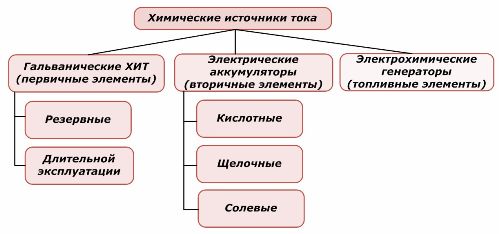
Класификация на химичните елементи
Електромоторна сила галванични клетки, в зависимост от дизайна, достига 1,2 ÷ 1,5 волта. За да получат големи стойности, те се комбинират в батерии, като се свързват последователно. Когато батериите са свързани паралелно, токът и мощността се увеличават.
Общоприето е, че първичните химически източници на ток не поддържат презареждане, въпреки че по-точно тази позиция може да бъде формулирана по различен начин: нейното прилагане не е икономически възможно.
Излишните първични химични източници на ток се съхраняват в състояние, при което електролитът е изолиран от електродите. Това елиминира появата на окислително-възстановителната реакция и гарантира готовност за въвеждане в експлоатация. Те не се използват повторно. Срокът на годност на химическите резервни източници на енергия е ограничен до 10–15 години.
Батериите се зареждат успешно с прилагането на външна електрическа енергия. Поради тази характеристика те се наричат вторични източници на ток. Те са в състояние да издържат на стотици и хиляди цикли на зареждане и заряд.EMF на батерията може да бъде в границите 1,0 ÷ 1,5 волта. Те също са комбинирани в батерии.
Електрохимичните генератори работят на принципа на галваничните клетки, но за да осъществят електрохимичната реакция, вещества идват отвън и всички освободени продукти се отстраняват от електролита. Това ви позволява да организирате непрекъснат процес.
Основни характеристики на химичните източници на енергия
1. Напрежението в отворените клеми
В зависимост от дизайна, един източник може да създаде само определена потенциална разлика. За използване в електрически устройства те се комбинират в батерии.
2. Специфичен капацитет
За определено време (в часове) един източник на химически ток може да генерира ограничено количество ток (в ампери), които се приписват на единица тегло или обем.
3. Плътност на мощността
Той характеризира способността на единица тегло или обем от химически източник на ток да генерира енергия, генерирана от произведеното напрежение, по силата на тока.
4. Продължителност на операцията
Този параметър се нарича още дата на изтичане.
5. Стойността на саморазреждащите се токове
Тези странични процеси на електрохимични реакции водят до изразходване на активната маса на елементите, предизвикват корозия и намаляват специфичния капацитет.
6. Цена на продукта
Зависи от дизайна, използваните материали и редица други фактори.
Най-добрите източници на химически ток са тези с високи стойности на първите четири параметъра, а саморазреждането и разходите са ниски.
Принципи на зареждане на батерията
Сред вторичните химически източници на ток те придобиват голяма популярност. литиево-йонни модели, които са станали широко използвани за захранване на електронни устройства. Те използват LiMO2 (M Co, Ni, Mn) като материал на положителния електрод, а графитът като отрицателен електрод.
Когато се зареждат, литиеви йони от приложената външна енергия се освобождават от катодния метал, преминават през електролита и проникват в пространството между графитните слоеве, натрупвайки се там.
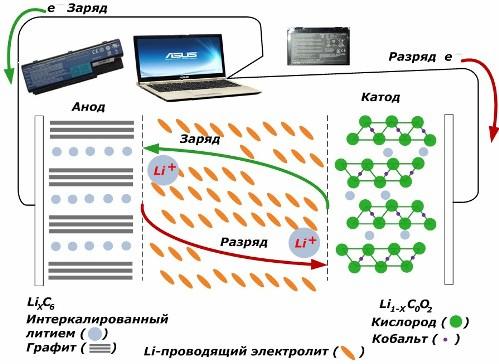
Когато енергията зарядно отсъства и натоварването е свързано с електродите, след това литиевите йони в електролита се движат в обратна посока.
Ако зареждането и разреждането не се извършват, тогава енергията в батерията не се изразходва, а се съхранява. Но количеството му е ограничено от свойствата на използваните материали. Например, в литиево-йонните батерии специфичният електрически капацитет е 130 ÷ 150 mAh / g. Той е ограничен от свойствата на анодния материал. За графита, капацитетът е около два пъти по-висок.
Учените търсят начини за увеличаване на капацитета на батерията, проучват възможността за използване на химическа реакция между литий и кислород във въздуха. За да направите това, дизайните са разработени с въздушен, неразходен катод, използван в отделни батерии. Този метод може да увеличи плътността на енергията до 10 пъти.
Работата на химичните източници на ток изисква познания основи на електротехниката, електрохимия, материалознание и физика на твърдото тяло.
Вижте също на i.electricianexp.com
: