Kategorijas: Piedāvātie raksti » Iesācēju elektriķi
Skatījumu skaits: 52646
Komentāri par rakstu: 4
Tranzistori 2. daļa. Diriģenti, izolatori un pusvadītāji
Raksta sākums: Tranzistora vēsture, Tranzistori: mērķis, ierīce un darbības principi
 Elektrotehnikā tiek izmantoti dažādi materiāli. Vielu elektriskās īpašības nosaka pēc elektronu skaita ārējā valences orbītā. Jo mazāk elektronu ir šajā orbītā, jo vājāki tie ir saistīti ar kodolu, jo vieglāk viņi var doties ceļojumā.
Elektrotehnikā tiek izmantoti dažādi materiāli. Vielu elektriskās īpašības nosaka pēc elektronu skaita ārējā valences orbītā. Jo mazāk elektronu ir šajā orbītā, jo vājāki tie ir saistīti ar kodolu, jo vieglāk viņi var doties ceļojumā.
Temperatūras svārstību ietekmē elektroni atdalās no atoma un pārvietojas interaktīvajā telpā. Šādus elektronus sauc par brīviem, un tie vadītājos rada elektrisko strāvu. Vai ir liela starpatomu telpa, vai ir brīvi elektroni, kas pārvietojas matērijas iekšienē?
Cietvielu un šķidrumu struktūra šķiet nepārtraukta un blīva, kas atgādina diega lodītes struktūru. Bet patiesībā pat cietās vielas ir vairāk kā zvejas vai volejbola tīkls. Protams, to nevar saskatīt sadzīves līmenī, taču ar precīziem zinātniskiem pētījumiem ir noskaidrots, ka attālumi starp elektroniem un atomu kodolu ir daudz lielāki nekā viņu pašu izmēri.
Ja atomu kodola lielums ir attēlots bumbiņas formā kā futbola bumbiņas lielums, tad šajā modelī elektroni būs zirņa lielumā, un katrs šāds zirnis atrodas no “kodola” vairāku simtu un pat tūkstošu metru attālumā. Un starp kodolu un elektronu ir tukšums - vienkārši nav nekā! Ja iedomājamies attālumus starp matērijas atomiem vienā mērogā, izmēri izrādīsies visnotaļ fantastiski - desmitiem un simtiem kilometru!
Labi elektrības vadītāji ir metāli. Piemēram, zelta un sudraba atomiem ārējā orbītā ir tikai viens elektrons, tāpēc tie ir labākie vadītāji. Dzelzs arī vada elektrību, bet nedaudz sliktāk.
Vadi elektrību vēl sliktāk sakausējumi ar augstu pretestību. Tie ir nihroms, manganīns, konstants, fehrals un citi. Šādas augstas pretestības sakausējumu dažādība ir saistīta ar faktu, ka tie ir paredzēti dažādu problēmu risināšanai: sildelementi, deformācijas mērinstrumenti, mērīšanas instrumentu atsauces rezistori un daudz kas cits.
Lai novērtētu materiāla spēju vadīt elektrību, ir izstrādāts jēdziens "Elektriskā vadītspēja". Atgriešanās vērtība ir pretestība. Mehānikā šie jēdzieni atbilst specifiskajam smagumam.
Izolatoriatšķirībā no vadītājiem nav sliecas zaudēt elektronus. Tajos elektronu saikne ar kodolu ir ļoti spēcīga, un brīvo elektronu gandrīz nav. Precīzāk, bet ļoti maz. Tajā pašā laikā dažos izolatoros to ir vairāk, un attiecīgi to sliktāka ir izolācijas kvalitāte. Pietiek salīdzināt, piemēram, keramiku un papīru. Tāpēc izolatorus nosacīti var iedalīt labajos un sliktajos.
Brīvo lādiņu parādīšanās pat izolatoros ir saistīta ar elektronu termiskām vibrācijām: augstas temperatūras ietekmē pasliktinās izolācijas īpašības, dažiem elektroniem joprojām izdodas atdalīties no kodola.
Tāpat ideāla vadītāja pretestība būtu nulle. Bet par laimi šāda diriģenta nav: iedomājieties, kā izskatās Ohma likums ((I = U / R) ar nulli saucējā !!! Atvadīšanās no matemātikas un elektrotehnikas.
Un tikai absolūtā nulles temperatūrā (-273,2 ° C) termiskās svārstības pilnībā izbeidzas, un sliktākais izolators kļūst pietiekami labs. Lai skaitliski noteiktu “tas” ir slikti - izmantojiet pretestības jēdzienu. Tā ir kuba, kura malas garums ir 1 cm, pretestība omos, pretestības dimensiju iegūst omos / cm. Dažu vielu īpatnējā pretestība ir parādīta zemāk.Vadītspēja ir pretestības abpusēja vērtība, ir Siemens mērvienība, - 1Sm = 1 / Ohm.
Viņiem ir laba vadītspēja vai maza pretestība: sudraba 1,5 * 10 ^ (- 6), lasiet, kā (no pusotra līdz desmit līdz jaudai mīnus seši), vara 1,78 * 10 ^ (- 6), alumīnija 2,8 * 10 ^ (- 6). Sakausējumu ar augstu pretestību vadītspēja ir daudz sliktāka: konstante 0,5 * 10 ^ (- 4), nihroms 1,1 * 10 ^ (- 4). Šos sakausējumus var saukt par sliktiem vadītājiem. Pēc visiem šiem sarežģītajiem skaitļiem aizstāt Ohm / cm.
Turklāt pusvadītājus var atšķirt kā atsevišķu grupu: germānija 60 omi / cm, silīcija 5000 omi / cm, selēns 100 000 omi / cm. Šīs grupas pretestība ir lielāka nekā sliktu vadītāju, bet mazāka nekā sliktu izolatoru, nemaz nerunājot par labiem. Droši vien ar tikpat lieliem panākumiem pusvadītājus varētu saukt par pusizolatoriem.
Pēc tik neilgas iepazīšanās ar atoma struktūru un īpašībām jāapsver, kā atomi mijiedarbojas viens ar otru, kā atomi mijiedarbojas viens ar otru, kā no tiem tiek veidotas molekulas, no kurām sastāv dažādas vielas. Lai to izdarītu, jums atkal būs jāatceras elektroni atoma ārējā orbītā. Galu galā tieši viņi piedalās atomu savienošanā molekulās un nosaka vielas fizikālās un ķīmiskās īpašības.
Kā no atomiem veido atomus
Jebkurš atoms ir stabilā stāvoklī, ja tā ārējā orbītā ir 8 elektroni. Viņš necenšas ņemt elektronus no kaimiņu atomiem, bet arī pats neatsakās. Lai to pārbaudītu, periodiskajā tabulā pietiek aplūkot inertās gāzes: neonu, argonu, kriptonu, ksenonu. Katra no tām ārējā orbītā ir 8 elektroni, kas izskaidro šo gāzu nevēlēšanos iesaistīties jebkādās attiecībās (ķīmiskās reakcijās) ar citiem atomiem, veidot ķīmisku vielu molekulas.
Situācija ir pavisam citāda tiem atomiem, kuru ārējā orbītā nav 8 loloto elektronu. Šādi atomi dod priekšroku apvienoties ar citiem, lai papildinātu savu ārējo orbītu ar līdz 8 elektroniem un atrastu mierīgu, stabilu stāvokli.
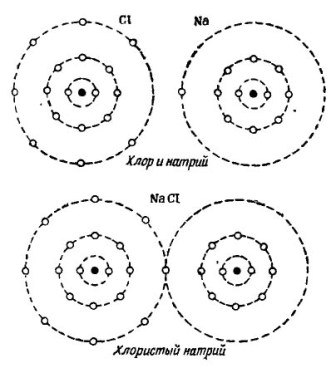
Piemēram, plaši pazīstamā ūdens molekula H2O. Tas sastāv no diviem ūdeņraža atomiem un viena skābekļa atoma, kā parādīts attēlā. 1.
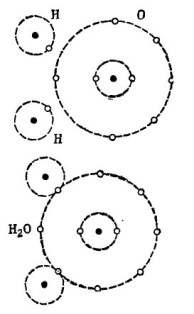
Zīmējums 1. Kā tiek veidota ūdens molekula.
Attēla augšējā daļā divi ūdeņraža atomi un viens skābekļa atoms ir parādīti atsevišķi. Skābekļa ārējā orbītā ir 6 elektroni, un tuvumā ir divi elektroni pie diviem ūdeņraža atomiem. Skābeklim, līdz lolotajam skaitlim 8, ārējā orbītā trūkst tikai divu elektronu, kurus viņš saņems, pievienojot sev divus ūdeņraža atomus.
Katra ūdeņraža atoma ārējā orbītā pilnīgai laimei trūkst 7 elektronu. Pirmais ūdeņraža atoms ārējā orbītā saņem 6 elektronus no skābekļa un vēl viens elektrons no sava dvīņa - otrais ūdeņraža atoms. Tagad tās ārējā orbītā kopā ar elektronu ir 8 elektroni. Otrais ūdeņraža atoms arī pabeidz savu ārējo orbītu līdz lolotākajam skaitlim 8. Šis process ir parādīts attēla apakšējā daļā. 1.
Attēlā 2 Parādīts nātrija un hlora atomu apvienošanas process. Rezultāts ir nātrija hlorīds, ko pārdod veikalos ar nosaukumu sāls.
Zīmējums 2. Nātrija un hlora atomu apvienošanas process
Arī šeit katrs no dalībniekiem saņem trūkstošo elektronu skaitu no otra: hlors piestiprina vienu nātrija elektronu pie saviem septiņiem elektroniem, bet tas piešķir savus atomus nātrija atomam. Abiem atomiem ārējā orbītā ir 8 elektroni, kur tiek panākta pilnīga vienošanās un labklājība.
Atomu valentība
Atomi ar 6 vai 7 elektroniem ārējā orbītā mēdz piestiprināt pie 1 vai 2 elektronus. Par šādiem atomiem viņi saka, ka tie ir viens vai divvērtīgi. Bet, ja atoma ārējā orbītā ir 1, 2 vai 3 elektroni, tad šādam atomam ir tendence tos atdot. Šajā gadījumā atoms tiek uzskatīts par vienu, diviem vai trīsvērtīgiem.
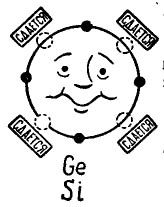
Ja atoma ārējā orbītā ir 4 elektroni, tad šāds atoms dod priekšroku apvienoties ar to pašu, kurā ir arī 4 elektroni. Tādējādi apvienojas tranzistoru ražošanā izmantotie germija un silīcija atomi. Šajā gadījumā atomus sauc par tetravalentiem. (Germānija vai silīcija atomus var kombinēt ar citiem elementiem, piemēram, ar skābekli vai ūdeņradi, taču šie savienojumi mūsu stāsta plānā nav interesanti.)
Attēlā 3 tiek parādīts germānija vai silīcija atoms, kurš vēlas apvienoties ar to pašu atomu. Mazi melni apļi ir paša atoma elektroni, un gaismas apļi norāda vietas, kur nokrīt četru atomu - kaimiņu - elektroni.
Zīmējums 3. Germānija (silīcija) atoms.
Pusvadītāju kristāla struktūra
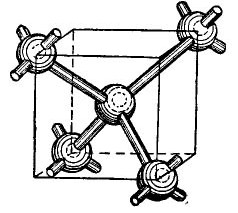
Periodiskajā tabulā esošie germānija un silīcija atomi ir tajā pašā grupā kā ogleklis (C dimanta ķīmiskā formula ir vienkārši lieli oglekļa kristāli, kas iegūti noteiktos apstākļos), un tāpēc, tos apvienojot, veido rombam līdzīgu kristālisku struktūru. Šādas struktūras izveidošana vienkāršotā, protams, parādīta attēlā 4.
Zīmējums 4.
Kuba centrā ir germānija atoms, un vēl 4 atomi atrodas stūros. Atoms, kas attēlots kuba centrā, ar valences elektroniem ir saistīts ar tuvākajiem kaimiņiem. Savukārt leņķiskie atomi dod savus valences elektronus atomam, kas atrodas kuba centrā, un tā kaimiņiem - atomiem, kas nav parādīti attēlā. Tādējādi ārējās orbītas papildina līdz astoņiem elektroniem. Protams, kristāla režģī nav kuba, tas ir tikai parādīts attēlā, lai atomu savstarpējais, tilpuma izkārtojums būtu skaidrs.
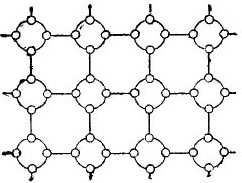
Bet, lai pēc iespējas vienkāršotu stāstu par pusvadītājiem, kristāla režģi var attēlot kā plakanu shematisku zīmējumu, neskatoties uz to, ka starpatomiskās saites tomēr atrodas telpā. Šāda shēma ir parādīta attēlā. 5.
Zīmējums 5. Germānijas kristāla režģis plakanā formā.
Šādā kristālā visi elektroni ir stingri piestiprināti atomiem ar to valences saitēm, tāpēc acīmredzot šeit vienkārši nav brīvu elektronu. Izrādās, ka priekšā mums ir izolators attēlā, jo tajā nav brīvu elektronu. Bet patiesībā tas tā nav.
Iekšējā vadītspēja
Fakts ir tāds, ka temperatūras ietekmē dažiem elektroniem joprojām izdodas atdalīties no atomiem un kādu laiku atbrīvoties no saites ar kodolu. Tāpēc germānija kristālā pastāv neliels daudzums brīvo elektronu, kuru dēļ ir iespējams vadīt elektrisko strāvu. Cik brīvu elektronu pastāv germānijas kristālā normālos apstākļos?
Uz 10 ^ 10 (desmit miljardiem) atomu nav vairāk kā divi šādi brīvie elektroni, tāpēc germānija ir slikta vadītāja vai, kā ierasts teikt, pusvadītājs. Jāatzīmē, ka tikai vienā gramā germānija ir 10 ^ 22 (desmit tūkstoši miljardu miljardu) atomu, kas ļauj "iegūt" apmēram divus tūkstošus miljardu brīvo elektronu. Šķiet, ka tas ir pietiekami, lai izietu lielu elektrisko strāvu. Lai risinātu šo jautājumu, pietiek atgādināt, kāda ir 1 A strāva.
1 A strāva atbilst tam, lai caur vadītāju vienā sekundē tiktu cauri elektriskajam lādiņam 1 kulons vai 6 * 10 ^ 18 (seši miljardi miljardu) elektronu sekundē. Ņemot to vērā, maz ticams, ka divi tūkstoši miljardu brīvo elektronu, kas izkliedēti pat milzīgā kristālā, nodrošinās lielu straumju pāreju. Lai gan termiskās kustības dēļ Vācijā ir maza vadītspēja. Šī ir tā saucamā iekšējā vadītspēja.
Elektroniskā un urbuma vadītspēja
Temperatūrai paaugstinoties, papildu enerģija tiek pārnesta uz elektroniem, to termiskās vibrācijas kļūst enerģētiskas, kā rezultātā dažiem elektroniem izdodas atdalīties no atomiem.Šie elektroni kļūst brīvi un, ja nav ārēja elektriskā lauka, izlases veidā kustas un pārvietojas brīvā telpā.
Atomi, kas zaudējuši elektronus, nevar veikt nejaušas kustības, bet tikai nedaudz svārstās attiecībā pret parasto stāvokli kristāla režģī. Šādus atomus, kuri zaudējuši elektronus, sauc par pozitīvajiem joniem. Mēs varam pieņemt, ka no to atomiem noplēstu elektronu vietā tiek iegūtas brīvas vietas, kuras parasti sauc par caurumiem.
Kopumā elektronu un caurumu skaits ir vienāds, tāpēc caurums var uztvert tuvumā esošo elektronu. Rezultātā pozitīvā jona atoms atkal kļūst neitrāls. Elektronu apvienošanas procesu ar caurumiem sauc par rekombināciju.
Tajā pašā frekvencē elektroni tiek atdalīti no atomiem, tāpēc vidēji elektronu un caurumu skaits konkrētam pusvadītājam ir vienāds, ir nemainīgs un atkarīgs no ārējiem apstākļiem, īpaši no temperatūras.
Ja pusvadītāju kristālam tiek pielietots spriegums, tad tiek pasūtīta elektronu kustība, caur kristālu plūst strāva tā elektronu un caurumu vadītspējas dēļ. Šo vadītspēju sauc par raksturīgo, tas jau tika minēts nedaudz augstāks.
Bet pusvadītāji tīrā veidā, kam ir elektroniska un caurumu vadītspēja, nav piemēroti diožu, tranzistoru un citu detaļu ražošanai, jo šo ierīču pamatā ir p-n (lasīt “pe-en”) savienojums.
Lai iegūtu šādu pāreju, nepieciešami divu veidu pusvadītāji, divu veidu vadītspēja (p - pozitīvs - pozitīvs, caurums) un (n - negatīvs - negatīvs, elektronisks). Šāda veida pusvadītājus iegūst, pieliekot dopingu, tīru germānija vai silīcija kristāliem pievienojot piemaisījumus.
Lai arī piemaisījumu daudzums ir ļoti mazs, to klātbūtne lielā mērā maina pusvadītāja īpašības, ļauj iegūt dažādas vadītspējas pusvadītājus. Tas tiks apspriests nākamajā raksta daļā.
Boriss Aladyshkin, https://i.electricianexp.com/lv
Skatīt arī vietnē i.electricianexp.com
: