Κατηγορίες: Αρχάριοι ηλεκτρολόγοι, Βιομηχανικός ηλεκτρολόγος
Αριθμός προβολών: 37528
Σχόλια σχετικά με το άρθρο: 0
Η πρακτική εφαρμογή της ηλεκτρόλυσης
Όταν ένα ηλεκτρικό ρεύμα διέρχεται μέσω ενός διαλύματος ή ενός τήγματος ηλεκτρολύτη, οι διαλυμένες ουσίες ή άλλες ουσίες που είναι προϊόντα δευτερογενών αντιδράσεων στα ηλεκτρόδια απελευθερώνονται στα ηλεκτρόδια. Αυτή η φυσικοχημική διαδικασία ονομάζεται ηλεκτρόλυση.
Η ουσία της ηλεκτρόλυσης
Στο ηλεκτρικό πεδίο που δημιουργείται από τα ηλεκτρόδια, τα ιόντα στο αγώγιμο υγρό έρχονται σε μια διατεταγμένη κίνηση. Το αρνητικό ηλεκτρόδιο είναι η κάθοδος, η θετική είναι η άνοδος.
Τα αρνητικά ιόντα που ονομάζονται ανιόντα (ιόντα της ομάδας υδροξυλίου και υπολείμματα οξέος) βυθίζονται στην άνοδο και τα θετικά ιόντα που ονομάζονται κατιόντα (υδρογόνο, μέταλλο, ιόντα αμμωνίου κλπ.) Βυθίζονται στην κάθοδο
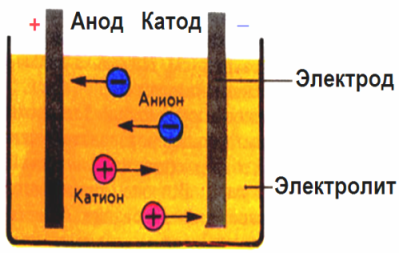
Μια διαδικασία οξείδωσης-αναγωγής λαμβάνει χώρα στα ηλεκτρόδια: η ηλεκτροχημική αναγωγή των σωματιδίων (άτομα, μόρια, κατιόντα) συμβαίνει στην κάθοδο και η ηλεκτροχημική οξείδωση των σωματιδίων (άτομα, μόρια, ανιόντα) συμβαίνει στην άνοδο. Οι αντιδράσεις διάστασης σε έναν ηλεκτρολύτη είναι πρωταρχικές αντιδράσεις και αντιδράσεις που προχωρούν απευθείας στα ηλεκτρόδια καλούνται δευτερογενείς.
Οι νόμοι της ηλεκτρόλυσης Faraday
Ο διαχωρισμός των αντιδράσεων ηλεκτρολύσεως σε πρωτογενή και δευτεροβάθμια βοήθησε τον Michael Faraday να θεσπίσει τους νόμους της ηλεκτρόλυσης:
-
Ο πρώτος νόμος της ηλεκτρόλυσης Faraday: η μάζα της ουσίας που εναποτίθεται στο ηλεκτρόδιο κατά τη διάρκεια της ηλεκτρόλυσης είναι άμεσα ανάλογη με την ποσότητα ηλεκτρικής ενέργειας που μεταφέρεται σε αυτό το ηλεκτρόδιο. Με την ποσότητα του ηλεκτρικού ρεύματος εννοείται ένα ηλεκτρικό φορτίο, που μετριέται, κατά κανόνα, σε μενταγιόν.
-
Ο δεύτερος νόμος της ηλεκτρόλυσης Faraday: για μια δεδομένη ποσότητα ηλεκτρικής ενέργειας (ηλεκτρικό φορτίο), η μάζα ενός χημικού στοιχείου που εναποτίθεται στο ηλεκτρόδιο είναι ευθέως ανάλογη προς την ισοδύναμη μάζα του στοιχείου. Η ισοδύναμη μάζα μιας ουσίας είναι η γραμμομοριακή μάζα της, διαιρούμενη με ακέραιο, ανάλογα με τη χημική αντίδραση στην οποία ενέχεται η ουσία.
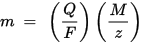
m είναι η μάζα της ουσίας που εναποτίθεται στο ηλεκτρόδιο, Q είναι το συνολικό ηλεκτρικό φορτίο που διέρχεται από την ουσία F = 96,485.33 (83) C mol - 1 είναι η σταθερά Faraday, M είναι η μοριακή μάζα της ουσίας (Για παράδειγμα, η γραμμομοριακή μάζα νερού H2O = 18 g / mol), z είναι ο αριθμός σθένους ιόντων μίας ουσίας (ο αριθμός των ηλεκτρονίων ανά ιόν).
Σημειώστε ότι το M / z είναι η ισοδύναμη μάζα της καταβυθισμένης ουσίας. Για τον πρώτο νόμο Faraday, M, F και z είναι σταθερές, τόσο μεγαλύτερη είναι η τιμή του Q, τόσο μεγαλύτερη είναι η τιμή του m. Για τον δεύτερο νόμο Faraday, Q, F και z είναι σταθερές, τόσο μεγαλύτερη είναι η τιμή M / z (ισοδύναμη μάζα), τόσο μεγαλύτερη είναι η τιμή m.
Η ηλεκτρόλυση χρησιμοποιείται ευρέως σήμερα στη βιομηχανία και στην τεχνολογία. Για παράδειγμα, η ηλεκτρόλυση χρησιμεύει ως μία από τις πιο αποτελεσματικές μεθόδους για τη βιομηχανική παραγωγή υδρογόνου, υπεροξειδίου του υδρογόνου, διοξειδίου του μαγγανίου, αλουμινίου, νατρίου, μαγνησίου, ασβεστίου και άλλων ουσιών. Η ηλεκτρόλυση χρησιμοποιείται για την επεξεργασία λυμάτων, στην ηλεκτρολυτική επίστρωση, στην ηλεκτρολυτική επικάλυψη και τελικά σε πηγές χημικού ρεύματος. Αλλά τα πρώτα πράγματα πρώτα.
Απόκτηση καθαρών μετάλλων από μεταλλεύματα με ηλεκτρόλυση
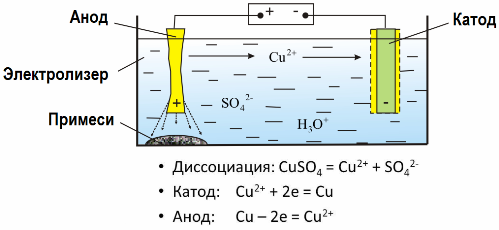
Χάρη στην ηλεκτρόλυση, πολλά μέταλλα εξάγονται από μεταλλεύματα και υποβάλλονται σε περαιτέρω επεξεργασία. Έτσι, όταν το μεταλλεύμα ή το εμπλουτισμένο συμπύκνωμα μεταλλεύματος υποβάλλεται σε επεξεργασία με αντιδραστήρια, το μέταλλο περνά μέσα στο διάλυμα και στη συνέχεια το μέταλλο εκχυλίζεται από το διάλυμα με ηλεκτροεκχύλιση. Καθαρό μέταλλο απελευθερώνεται ταυτόχρονα στην κάθοδο. Με αυτόν τον τρόπο λαμβάνουν ψευδάργυρο, χαλκό, κάδμιο.
Τα μέταλλα υποβάλλονται σε ηλεκτροκατεργασία για την εξάλειψη των ακαθαρσιών και για τη μετατροπή των περιεχόμενων ακαθαρσιών σε μορφή κατάλληλη για περαιτέρω επεξεργασία. Το προς καθαρισμό μέταλλο χυτεύεται με τη μορφή πλακών και αυτές οι πλάκες χρησιμοποιούνται ως ανόδους στην ηλεκτρόλυση.
Όταν το ρεύμα περνά, το μέταλλο της ανόδου διαλύεται, περνά με τη μορφή κατιόντων στο διάλυμα, κατόπιν τα κατιόντα εκκενώνονται στην κάθοδο και σχηματίζουν ένα ίζημα καθαρού μετάλλου. Οι ακαθαρσίες της ανόδου δεν διαλύονται - καθιζάνουν με τον πολτό ανόδου ή περνούν στον ηλεκτρολύτη, από όπου αφαιρούνται συνεχώς ή περιοδικά.
Σκεφθείτε ως παράδειγμα ηλεκτροκατεργασία χαλκού. Το κύριο συστατικό της λύσης - θειικό χαλκό - το πιο κοινό και φθηνότερο άλας αυτού του μετάλλου. Η λύση έχει χαμηλή ηλεκτρική αγωγιμότητα. Για να αυξηθεί, προστίθεται θειικό οξύ στον ηλεκτρολύτη.
Επιπλέον, στο διάλυμα προστίθενται μικρές ποσότητες προσθέτων για να διευκολυνθεί ο σχηματισμός ενός συμπαγούς ιζήματος μετάλλου. Γενικά, ο χαλκός, το νικέλιο, ο μόλυβδος, ο κασσίτερος, το ασήμι και ο χρυσός υποβάλλονται σε ηλεκτρολυτική εξευγενισμό.
Επεξεργασία λυμάτων ηλεκτρόλυσης
Η ηλεκτρόλυση χρησιμοποιείται στην επεξεργασία λυμάτων (διεργασίες ηλεκτροσυσσωμάτωσης, ηλεκτροεκχύλισης και ηλεκτροεμβολιασμού). Η μέθοδος ηλεκτροχημικού καθαρισμού είναι μία από τις πιο συνήθεις. Για την ηλεκτρόλυση χρησιμοποιούνται αδιάλυτες ανόδους (μαγνητίτης, οξείδιο μολύβδου, γραφίτης, μαγγάνιο, οι οποίες εναποτίθενται σε βάση τιτανίου) ή διαλυτές (αλουμίνιο, σίδηρος).
Αυτή η μέθοδος χρησιμοποιείται για την απομόνωση τοξικών οργανικών και ανόργανων ουσιών από το νερό. Για παράδειγμα, οι χαλκοσωλήνες αποσυναρμολογούνται με διάλυμα θειικού οξέος και τα βιομηχανικά λύματα πρέπει στη συνέχεια να καθαρίζονται με ηλεκτρόλυση με αδιάλυτη άνοδο. Ο χαλκός απελευθερώνεται στην κάθοδο, ο οποίος μπορεί και πάλι να χρησιμοποιηθεί στην ίδια επιχείρηση.
Τα αλκαλικά λύματα καθαρίζονται με ηλεκτρόλυση από ενώσεις κυανίου. Προκειμένου να επιταχυνθεί η οξείδωση των κυανιδίων, να αυξηθεί η ηλεκτρική αγωγιμότητα και να εξοικονομηθεί ενέργεια, ένα πρόσθετο με τη μορφή χλωριούχου νατρίου χρησιμοποιείται στο νερό.
Η ηλεκτρόλυση διεξάγεται με μία άνοδο γραφίτη και μία χαλύβδινη κάθοδο. Τα κυανίδια καταστρέφονται κατά την ηλεκτροχημική οξείδωση και το χλώριο, το οποίο απελευθερώνεται στην άνοδο. Η αποτελεσματικότητα αυτού του καθαρισμού είναι κοντά στο 100%.
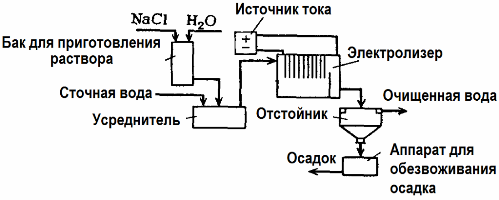
Εκτός από τον άμεσο ηλεκτροχημικό καθαρισμό, μπορεί να συμπεριληφθεί στη διαδικασία ηλεκτρόλυσης θρόμβωση. Εξαιρουμένης της προσθήκης αλάτων, η ηλεκτρόλυση διεξάγεται με διαλυτές ανόδους αλουμινίου ή σιδήρου. Στη συνέχεια, όχι μόνο οι μολυντές στην άνοδο καταστρέφονται, αλλά η ίδια η άνοδο διαλύεται. Ενεργοποιούνται διασκορπισμένες ενώσεις που σχηματίζουν κολλοειδή (πυκνωμένα) διασκορπισμένα ρυπαντικά.
Αυτή η μέθοδος είναι αποτελεσματική στην επεξεργασία υγρών αποβλήτων από λίπη, προϊόντα πετρελαίου, βαφές, έλαια, ραδιενεργές ουσίες κλπ. Ονομάζεται ηλεκτροκολπίτιδα.
Γαλβανοποίηση
Η ηλεκτρολυτική επικάλυψη είναι η ηλεκτρολυτική εναπόθεση ορισμένων μετάλλων με σκοπό την προστασία των προϊόντων από τη διάβρωση και την παροχή της κατάλληλης αισθητικής εμφάνισης (η επίστρωση γίνεται με χρώμιο, νικέλιο, ασήμι, χρυσό, πλατίνα κλπ.). Το αντικείμενο καθαρίζεται πλήρως, απολιπανθεί και χρησιμοποιείται ως κάθοδος σε ηλεκτρολυτικό λουτρό στο οποίο χύνεται ένα διάλυμα άλατος του μετάλλου με το οποίο είναι απαραίτητο να επικαλυφθεί το προϊόν.
Μια πλάκα του ίδιου μετάλλου χρησιμοποιείται ως άνοδος. Κατά κανόνα χρησιμοποιείται ένα ζεύγος δίσκων ανόδου και το αντικείμενο που πρόκειται να γαλβανισθεί τοποθετείται μεταξύ τους.
Ηλεκτροδιαμόρφωση
Γαλακτωματοποίηση - η εναπόθεση μετάλλου στην επιφάνεια διαφορετικών σωμάτων για την αναπαραγωγή των σχημάτων τους: καλούπια για μέρη χύτευσης, γλυπτά, τυπωμένα κλισέ κλπ.

Η γαλβανική εναπόθεση μετάλλου στην επιφάνεια ενός αντικειμένου είναι δυνατή μόνο όταν αυτή η επιφάνεια ή ολόκληρο το αντικείμενο είναι ένας αγωγός ηλεκτρικού ρεύματος, οπότε συνιστάται η χρήση μετάλλων για την κατασκευή μοντέλων ή μορφών. Τα εύτηκτα μέταλλα είναι τα πλέον κατάλληλα για το σκοπό αυτό: μολύβδου, κασσίτερου, συγκολλητικά, κράμα ξύλου.
Τα μέταλλα αυτά είναι μαλακά, εύκολα επεξεργασμένα με μεταλλικά εργαλεία, χαραγμένα και χυτά. Μετά το σχηματισμό του γαλβανικού στρώματος και το φινίρισμα, το μεταλλικό καλούπι τήκεται από το τελικό προϊόν.
Ωστόσο, οι μεγαλύτερες ευκαιρίες για την κατασκευή των μοντέλων εξακολουθούν να αντιπροσωπεύονται από διηλεκτρικά υλικά. Για την μεταλλοποίηση τέτοιων μοντέλων, είναι απαραίτητο να δοθεί η ηλεκτρική αγωγιμότητα στην επιφάνεια τους. Η επιτυχία ή η αποτυχία τελικά εξαρτάται κυρίως από την ποιότητα του αγώγιμου στρώματος. Αυτό το στρώμα μπορεί να εφαρμοστεί με έναν από τους τρεις τρόπους.
Ο πιο συνηθισμένος τρόπος είναι γραφιτικοποίηση, είναι κατάλληλο για μοντέλα πλαστελίνης και άλλων υλικών που επιτρέπουν την άλεση γραφίτη στην επιφάνεια.
Το επόμενο τέχνασμα είναι μπρούντζινο, η μέθοδος είναι καλή για μοντέλα σχετικά σύνθετου σχήματος, για διαφορετικά υλικά, ωστόσο, λόγω του πάχους του χάλκινου στρώματος, η μεταφορά μικρών λεπτομερειών είναι κάπως παραμορφωμένη.
Και τελικά ασημένιακατάλληλο για όλες τις περιπτώσεις, αλλά ιδιαίτερα απαραίτητο για εύθραυστα μοντέλα με πολύ περίπλοκο σχήμα - φυτά, έντομα κλπ.
Πηγές χημικού ρεύματος
Επίσης, η ηλεκτρόλυση είναι η κύρια διαδικασία λόγω της οποίας λειτουργούν οι πιο σύγχρονες πηγές χημικού ρεύματος, όπως οι μπαταρίες και οι συσσωρευτές. Υπάρχουν δύο ηλεκτρόδια σε επαφή με τον ηλεκτρολύτη.
Διαπιστώνεται δυναμική διαφορά μεταξύ των ηλεκτροδίων - ηλεκτροκινητική δύναμη που αντιστοιχεί στην ελεύθερη ενέργεια της αντίδρασης οξειδοαναγωγής. Δείτε εδώ για περισσότερες λεπτομέρειες: Χημικές πηγές ηλεκτρικού ρεύματος
Μπαταρία Λεμονιού (κάντε κλικ στην εικόνα για μεγέθυνση)
Η δράση των πηγών χημικού ρεύματος βασίζεται στην εμφάνιση χωρικά διαχωρισμένων διεργασιών με κλειστό εξωτερικό κύκλωμα: στην αρνητική άνοδο, ο αναγωγικός παράγοντας οξειδώνεται, τα ελεύθερα ηλεκτρόνια που σχηματίζονται διέρχονται από το εξωτερικό κύκλωμα στην θετική κάθοδο, δημιουργώντας ρεύμα εκφόρτισης όπου συμμετέχουν στην αντίδραση αναγωγής οξείδωσης. Έτσι, η ροή αρνητικά φορτισμένων ηλεκτρονίων κατά μήκος του εξωτερικού κυκλώματος πηγαίνει από την άνοδο στην κάθοδο, δηλαδή από το αρνητικό ηλεκτρόδιο στο θετικό.
Δείτε επίσης στο i.electricianexp.com
: