Kategorien: Ausgewählte Artikel » Elektrikeranfänger
Anzahl der Ansichten: 36288
Kommentare zum Artikel: 1
Chemische Stromquellen: Hauptmerkmale
 Seit mehr als zwei Jahrhunderten nutzt die Menschheit die Energie chemischer Reaktionen zwischen verschiedenen Substanzen, um Gleichstrom zu erzeugen.
Seit mehr als zwei Jahrhunderten nutzt die Menschheit die Energie chemischer Reaktionen zwischen verschiedenen Substanzen, um Gleichstrom zu erzeugen.
Arbeitsprinzip
Die Redoxreaktion zwischen Substanzen mit den Eigenschaften eines Oxidationsmittels und eines Reduktionsmittels geht mit der Freisetzung von Elektronen einher, deren Bewegung einen elektrischen Strom bildet. Um seine Energie nutzen zu können, müssen jedoch Bedingungen für den Durchgang von Elektronen durch einen externen Kreislauf geschaffen werden, andernfalls wird es durch Wärme aus einem einfachen Gemisch aus Oxidationsmittel und Reduktionsmittel freigesetzt.
Daher haben alle chemischen Stromquellen zwei Elektroden:
-
die Anode, an der Oxidation auftritt;
-
Kathode, die die Wiederherstellung der Substanz durchführt.
In einiger Entfernung befindliche Elektroden werden mit einem Elektrolyten in ein Gefäß gegeben - eine Substanz, die aufgrund der Dissoziationsprozesse des Mediums in Ionen elektrischen Strom leitet.
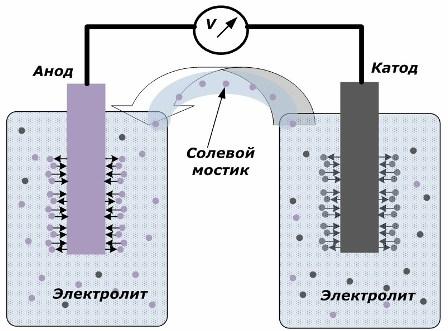
Das Prinzip der Umwandlung chemischer Energie in elektrische Energie
Die Abbildung zeigt, dass die Elektroden in getrennten Gefäßen angeordnet sind, die durch eine Salzbrücke verbunden sind, durch die die Bewegung von Ionen entlang des internen Kreislaufs erzeugt wird. Wenn der externe und der interne Stromkreis offen sind, treten an den Elektroden zwei Prozesse auf: der Übergang von Ionen vom Metall der Elektrode zum Elektrolyten und der Übergang von Ionen vom Elektrolyten zum Kristallgitter der Elektroden.
Die Durchflussraten dieser Prozesse sind gleich und die Spannungspotentiale mit entgegengesetzten Vorzeichen werden an jeder Elektrode akkumuliert. Wenn sie über eine Salzbrücke verbunden sind und eine Last angelegt wird, tritt ein Stromkreis auf. Ein interner Strom wird durch die Bewegung von Ionen zwischen den Elektroden durch den Elektrolyten und die Salzbrücke erzeugt. Die Bewegung von Elektronen entlang des externen Stromkreises in Richtung von der Anode zur Kathode.
Fast alle Redoxreaktionen gehen mit einer Stromerzeugung einher. Sein Wert hängt jedoch von vielen Faktoren ab, einschließlich des Volumens und der Masse der verwendeten Chemikalien, der zur Herstellung der Elektroden verwendeten Materialien wie Elektrolyt, Ionenkonzentration und Design.
Die in modernen chemischen Stromquellen am häufigsten verwendeten sind:
-
für das Material der Anode (Reduktionsmittel) Zink (Zn), Blei (Pb), Cadmium (Cd) und einige andere Metalle;
-
für das Kathodenmaterial (Oxidationsmittel) - Bleioxid PbO 2, Manganoxid MnO 2, Nickelhydroxid NiOOH und andere;
-
Elektrolyte auf Basis von Säuren, Laugen oder Salzen.
Klassifizierungsmethoden
Ein Teil der chemischen Energiequellen kann wiederverwendet werden, der andere nicht. Dieses Prinzip wird als Grundlage für ihre Klassifizierung herangezogen.
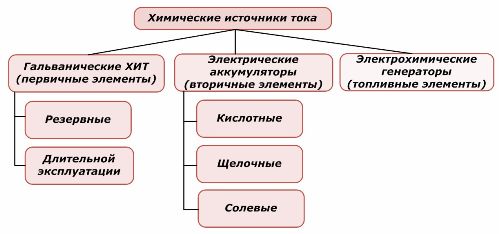
Klassifizierung chemischer Elemente
Elektromotorische Kraft galvanische Zellenerreicht je nach Ausführung 1,2 ÷ 1,5 Volt. Um große Werte zu erhalten, werden sie zu Batterien kombiniert, die in Reihe geschaltet werden. Wenn die Batterien parallel geschaltet werden, erhöhen sich Strom und Leistung.
Es ist allgemein anerkannt, dass primäre chemische Stromquellen das Wiederaufladen nicht unterstützen, obwohl diese Position genauer anders formuliert werden kann: Ihre Implementierung ist wirtschaftlich nicht machbar.
Redundante primäre chemische Stromquellen werden in einem Zustand gespeichert, in dem der Elektrolyt von den Elektroden isoliert ist. Dies eliminiert das Auftreten der Redoxreaktion und stellt die Bereitschaft zur Inbetriebnahme sicher. Sie werden nicht wiederverwendet. Die Haltbarkeit chemischer Notstromquellen ist auf 10 bis 15 Jahre begrenzt.
Batterien werden durch Aufbringen externer elektrischer Energie erfolgreich aufgeladen. Aufgrund dieser Funktion werden sie als Sekundärstromquellen bezeichnet. Sie sind in der Lage, Hunderten und Tausenden von Lade- / Entladezyklen standzuhalten.Die EMF der Batterie kann im Bereich von 1,0 bis 1,5 Volt liegen. Sie werden auch zu Batterien kombiniert.
Elektrochemische Generatoren arbeiten nach dem Prinzip galvanischer Zellen, aber um die elektrochemische Reaktion durchzuführen, kommen Substanzen von außen und alle freigesetzten Produkte werden aus dem Elektrolyten entfernt. Auf diese Weise können Sie einen kontinuierlichen Prozess organisieren.
Wichtige Leistungsmerkmale chemischer Energiequellen
1. Die Spannung an offenen Klemmen
Je nach Design kann eine einzelne Quelle nur eine bestimmte Potentialdifferenz erzeugen. Zur Verwendung in elektrischen Geräten werden sie zu Batterien kombiniert.
2. Spezifische Kapazität
Für eine bestimmte Zeit (in Stunden) kann eine chemische Stromquelle eine begrenzte Strommenge (in Ampere) erzeugen, die einer Gewichts- oder Volumeneinheit zugeordnet wird.
3. Leistungsdichte
Es charakterisiert die Fähigkeit einer Gewichts- oder Volumeneinheit einer chemischen Stromquelle, Strom zu erzeugen, der durch das Produkt aus Spannung und Stromstärke erzeugt wird.
4. Betriebsdauer
Dieser Parameter wird auch als Ablaufdatum bezeichnet.
5. Der Wert der Selbstentladungsströme
Diese Nebenprozesse elektrochemischer Reaktionen führen zum Verbrauch der aktiven Masse der Elemente, verursachen Korrosion und verringern die spezifische Kapazität.
6. Produktpreis
Hängt vom Design, den verwendeten Materialien und einer Reihe anderer Faktoren ab.
Die besten chemischen Stromquellen sind solche mit hohen Werten der ersten vier Parameter, und Selbstentladung und Kosten sind gering.
Prinzipien der Batterieladung
Unter den sekundären chemischen Stromquellen gewinnen sie an Popularität. Lithium-Ionen-Modelle, die weit verbreitet sind, um elektronische Geräte anzutreiben. Sie verwenden LiMO2 (M Co, Ni, Mn) als Material der positiven Elektrode und Graphit als negatives.
Beim Laden werden Lithiumionen aus der angelegten externen Energie aus dem Kathodenmetall freigesetzt, passieren den Elektrolyten und dringen in den Raum zwischen den Graphitschichten ein und sammeln sich dort an.
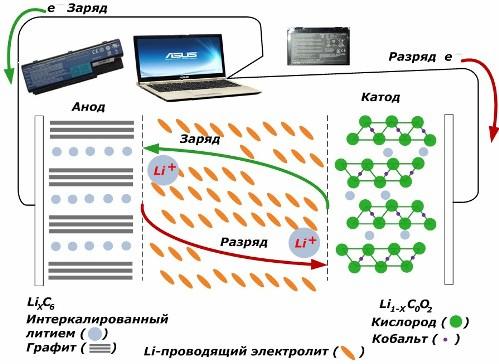
Wenn die Energie Ladegerät fehlt und die Last mit den Elektroden verbunden ist, bewegen sich Lithiumionen im Elektrolyten in die entgegengesetzte Richtung.
Wenn das Laden und Entladen nicht durchgeführt wird, wird die Energie in der Batterie nicht verbraucht, sondern gespeichert. Ihre Menge ist jedoch durch die Eigenschaften der verwendeten Materialien begrenzt. Beispielsweise beträgt in Lithium-Ionen-Batterien die spezifische elektrische Kapazität 130 bis 150 mAh / g. Es ist durch die Eigenschaften des Anodenmaterials begrenzt. Bei Graphit ist die Kapazität etwa doppelt so hoch.
Wissenschaftler suchen nun nach Wegen, um die Batteriekapazität zu erhöhen, und untersuchen die Möglichkeit einer chemischen Reaktion zwischen Lithium und Sauerstoff in der Luft. Zu diesem Zweck werden Konstruktionen mit einer nicht verbrauchbaren Luftkathode entwickelt, die in separaten Batterien verwendet wird. Diese Methode kann die Energiedichte bis zum 10-fachen erhöhen.
Der Betrieb chemischer Stromquellen erfordert Kenntnisse Grundlagen der Elektrotechnik, Elektrochemie, Materialwissenschaften und Festkörperphysik.
Siehe auch auf i.electricianexp.com
:
