Kategorien: Ausgewählte Artikel » Elektrikeranfänger
Anzahl der Ansichten: 70526
Kommentare zum Artikel: 0
Galvanische Zellen - Gerät, Funktionsprinzip, Typen und Hauptmerkmale
Voraussetzungen für das Erscheinungsbild galvanischer Zellen. Ein bisschen Geschichte. 1786 entdeckte der italienische Medizinprofessor, der Physiologe Luigi Aloisio Galvani, ein interessantes Phänomen: Die Muskeln der Hinterbeine einer frisch geöffneten Leiche eines Frosches, der an Kupferhaken aufgehängt war, zogen sich zusammen, als der Wissenschaftler sie mit einem Stahlskalpell berührte. Galvani kam sofort zu dem Schluss, dass dies eine Manifestation von "tierischer Elektrizität" war.
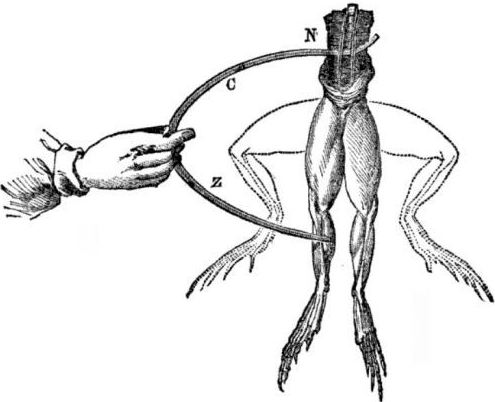
Nach dem Tod von Galvani wird sein Zeitgenosse Alessandro Volta als Chemiker und Physiker einen realistischeren Mechanismus für das Auftreten von elektrischem Strom beim Kontakt verschiedener Metalle beschreiben und öffentlich demonstrieren.
Volta wird nach einer Reihe von Experimenten zu dem eindeutigen Schluss kommen, dass der Strom im Stromkreis aufgrund des Vorhandenseins von zwei Leitern verschiedener Metalle in einer Flüssigkeit auftritt, und dies ist überhaupt keine „tierische Elektrizität“, wie Galvani dachte. Das Zucken der Froschschenkel war eine Folge der Wirkung des Stroms, der durch den Kontakt verschiedener Metalle (Kupferhaken und Stahlskalpell) entsteht.
Volta wird das gleiche Phänomen zeigen, das Galvani an einem toten Frosch zeigte, jedoch an einem völlig unbelebten hausgemachten Elektrometer, und 1800 eine genaue Erklärung des Stroms geben: „Der Leiter zweiter Klasse (Flüssigkeit) befindet sich in der Mitte und steht in Kontakt mit zwei erstklassigen Leitern von zwei verschiedenen Metalle ... Dadurch entsteht ein elektrischer Strom in die eine oder andere Richtung. “

In einem der ersten Experimente senkte Volta zwei Platten - Zink und Kupfer - in ein Gefäß mit Säure und verband sie mit Draht. Danach begann sich die Zinkplatte aufzulösen und es bildeten sich Gasblasen auf dem Kupferstahl. Volta schlug vor und bewies, dass elektrischer Strom durch den Draht fließt.
So wurde das "Volta-Element" erfunden - die erste galvanische Zelle. Zur Vereinfachung gab Volta ihm die Form eines vertikalen Zylinders (Säule), der aus miteinander verbundenen Ringen aus Zink, Kupfer und mit Säure imprägniertem Stoff bestand. Ein einen halben Meter hoher Voltpol erzeugte eine für Menschen empfindliche Spannung.
Seit Beginn der Forschung wurde von Luigi Galvani der Name gelegt chemische Stromquelle bewahrte die Erinnerung an ihn in seinem Namen.
Galvanische Zelle Ist eine chemische Stromquelle, die auf der Wechselwirkung zweier Metalle und / oder ihrer Oxide in einem Elektrolyten beruht und zum Auftreten eines elektrischen Stroms in einem geschlossenen Kreislauf führt. So wird in galvanischen Zellen chemische Energie in elektrische Energie umgewandelt.
Zellen heute

Zellen werden heute Batterien genannt. Drei Arten von Batterien sind weit verbreitet: Kochsalzlösung (trocken), alkalisch (sie werden in der englischen Übersetzung auch als alkalisch, "alkalisch" bezeichnet - "alkalisch") und Lithium. Das Prinzip ihrer Arbeit ist das gleiche wie das von Volta im Jahr 1800 beschriebene: zwei Metalle durch Elektrolyt interagierenund ein elektrischer Strom entsteht in einem externen geschlossenen Stromkreis.
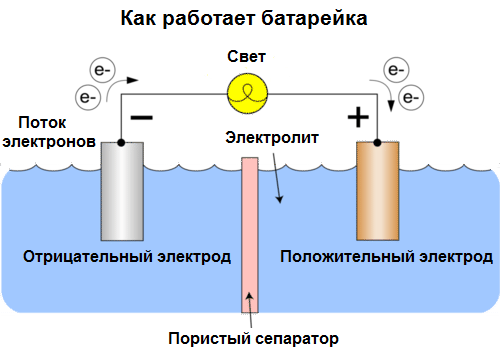
Die Batteriespannung hängt von den verwendeten Metallen und der Anzahl der Zellen in der "Batterie" ab. Batterien sind im Gegensatz zu Batterien nicht in der Lage, ihre Eigenschaften wiederherzustellen, da sie chemische Energie, dh die Energie der Reagenzien (Reduktionsmittel und Oxidationsmittel), aus denen die Batterie besteht, direkt in elektrische Energie umwandeln.
Die in der Batterie enthaltenen Reagenzien werden während des Betriebs verbraucht, der Strom nimmt allmählich ab, sodass die Wirkung der Quelle endet, nachdem die Reagenzien vollständig reagiert haben.
Alkali- und Salzelemente (Batterien) werden häufig zur Stromversorgung einer Vielzahl von elektronischen Geräten, Funkgeräten, Spielzeugen verwendet, und Lithium ist am häufigsten in tragbaren medizinischen Geräten wie Blutzuckermessgeräten oder in digitalen Technologien wie Kameras zu finden.

Salzbatterien
Mangan-Zink-Zellen, sogenannte Salzbatterien, sind „trockene“ galvanische Zellen, in denen sich keine flüssige Elektrolytlösung befindet.
Eine Zinkelektrode (+) ist eine becherförmige Kathode, und eine Pulvermischung aus Mangandioxid mit Graphit dient als Anode. Strom fließt durch einen Graphitstab. Als Elektrolyt wird eine Paste aus einer Ammoniumchloridlösung unter Zusatz von Stärke oder Mehl zum Eindicken verwendet, so dass nichts fließt.
In der Regel geben die Batteriehersteller nicht die genaue Zusammensetzung der Salzelemente an. Salzbatterien sind jedoch die billigsten. Sie werden normalerweise in Geräten verwendet, bei denen der Stromverbrauch extrem niedrig ist: in Stunden, in Fernbedienungen, in elektronischen Thermometern usw.

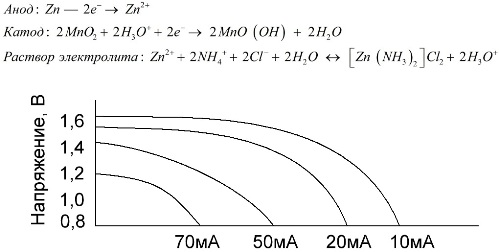
Das Konzept der "Nennkapazität" wird selten zur Charakterisierung von Mangan-Zink-Batterien verwendet, da ihre Kapazität stark von den Betriebsbedingungen und -bedingungen abhängt. Die Hauptnachteile dieser Elemente sind eine signifikante Spannungsreduzierungsrate während der Entladung und eine signifikante Abnahme der Ausgangskapazität mit zunehmendem Entladestrom. Die endgültige Entladespannung wird abhängig von der Last im Bereich von 0,7 bis 1,0 V eingestellt.
Es ist nicht nur die Größe des Entladestroms wichtig, sondern auch der Zeitplan der Last. Bei intermittierenden Entladungen großer und mittlerer Ströme steigt die Leistung der Batterien im Vergleich zum Dauerbetrieb deutlich an. Bei kleinen Entladeströmen und monatelangen Betriebsunterbrechungen kann sich ihre Kapazität jedoch aufgrund der Selbstentladung verringern.
Die obige Grafik zeigt die Entladungskurven für eine durchschnittliche Salzbatterie für 4, 10, 20 und 40 Stunden zum Vergleich mit einer alkalischen, auf die später eingegangen wird.
Alkalibatterien
Eine Alkalibatterie ist eine galvanische Mangan-Zink-Batterie, bei der Mangandioxid als Kathode, Zinkpulver als Anode und eine Alkalilösung als Elektrolyt verwendet werden, üblicherweise in Form einer Kaliumhydroxidpaste.
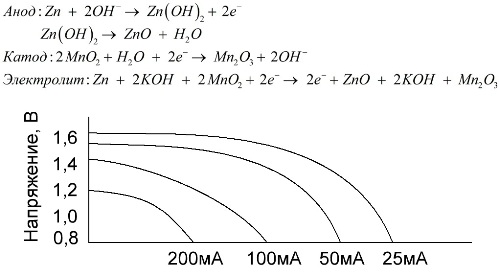
Diese Batterien haben eine Reihe von Vorteilen (insbesondere eine deutlich größere Kapazität, eine bessere Leistung bei niedrigen Temperaturen und hohe Lastströme).

Alkalibatterien können im Vergleich zu Kochsalzlösung lange Zeit mehr Strom liefern. Ein größerer Strom wird möglich, weil hier Zink nicht in Form eines Glases, sondern in Form eines Pulvers mit größerer Kontaktfläche zum Elektrolyten verwendet wird. Als Elektrolyt wird Kaliumhydroxid in Form einer Paste verwendet.
Dank der Fähigkeit dieser Art von galvanischen Zellen, über einen langen Zeitraum einen signifikanten Strom (bis zu 1 A) zu liefern, sind Alkalibatterien derzeit am gebräuchlichsten.
In elektrischem Spielzeug, in tragbaren medizinischen Geräten, in elektronischen Geräten, in Kameras werden überall Alkalibatterien verwendet. Sie dienen 1,5-mal länger als Kochsalzlösung, wenn die Entladung stromsparend ist. Die Grafik zeigt die Entladungskurven bei verschiedenen Strömen zum Vergleich mit einer Salzbatterie (die Grafik wurde oben angegeben) für 4, 10, 20 und 40 Stunden.
Lithiumbatterien
Ein anderer ziemlich häufiger Typ von galvanischen Zellen sind Lithiumbatterien - einzelne nicht wiederaufladbare galvanische Zellen, in denen Lithium oder seine Verbindungen als Anode verwendet werden. Aufgrund der Verwendung von Alkalimetall weisen sie eine hohe Potentialdifferenz auf.

Die Kathode und der Elektrolyt einer Lithiumzelle können sehr unterschiedlich sein, daher kombiniert der Begriff „Lithiumzelle“ eine Gruppe von Zellen mit demselben Anodenmaterial.Als Kathode können beispielsweise Mangandioxid, Kohlenmonofluorid, Pyrit, Thionylchlorid usw. verwendet werden.
Lithiumbatterien unterscheiden sich von anderen Batterien durch hohe Laufzeit und hohe Kosten. Abhängig von der gewählten Größe und den verwendeten chemischen Materialien kann eine Lithiumbatterie Spannungen von 1,5 V (kompatibel mit Alkalibatterien) bis 3,7 V erzeugen.
Diese Batterien haben die höchste Kapazität pro Masseneinheit und eine lange Haltbarkeit. Lithiumzellen werden häufig in modernen tragbaren elektronischen Geräten verwendet: zur Stromversorgung von Uhren auf Computer-Motherboards, zur Stromversorgung von tragbaren medizinischen Geräten, Uhren, Taschenrechnern, in fotografischen Geräten usw.
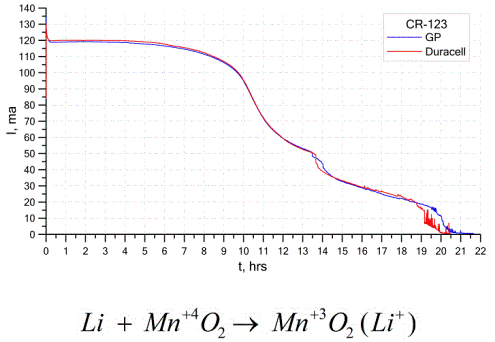
Die obige Grafik zeigt die Entladungskurven für zwei Lithiumbatterien von zwei bekannten Herstellern. Der Anfangsstrom betrug 120 mA (pro Widerstand in der Größenordnung von 24 Ohm).
Siehe auch: Moderne Akkus - Vor- und Nachteile
Siehe auch auf i.electricianexp.com
: